Уравнение Менделеева-Клапейpона
Определение и формула уравнения Менделеева-Клапейpона
Если рассматривать некоторое количество газа, то эмпирически получено, что давление (![]() ), объем (
), объем (![]() ) и температура (
) и температура (![]() ) полностью характеризуют эту массу газа как термодинамическую систему, если данный газ можно представить в виде совокупности нейтральных молекул, не имеющих дипольных моментов. В состоянии термодинамического равновесия
) полностью характеризуют эту массу газа как термодинамическую систему, если данный газ можно представить в виде совокупности нейтральных молекул, не имеющих дипольных моментов. В состоянии термодинамического равновесия ![]() связаны между собой уравнением состояния.
связаны между собой уравнением состояния.
![]()
(где ![]() — масса газа;
— масса газа; ![]() — молярная масса газа;
— молярная масса газа; ![]() Дж/Моль•К — универсальная газовая постоянная; температура воздуха в Кельвинах:
Дж/Моль•К — универсальная газовая постоянная; температура воздуха в Кельвинах: ![]() ) было впервые получено Менделеевым.
) было впервые получено Менделеевым.
Его легко получить из уравнения Клапейpона:
![]()
учитывая, что в соответствии с законом Авогадро один моль любого газа при нормальных условиях занимает объем ![]() л. При этом получается, что:
л. При этом получается, что:
![]()
![]()
Уравнение (1) называют уравнением Менделеева-Клапейpона. Иногда его записывают как:
![]()
где ![]() — количество вещества (число молей газа).
— количество вещества (число молей газа).
Уравнение Менделеева-Клапейpона получено на основе установленных эмпирически газовых законов. Так же как и газовые законы, уравнение Менделеева-Клапейpона является приближенным. Для разных газов границы применимости данного уравнения различны. Например, для гелия уравнение (1) справедливо в более широком диапазоне температур, чем для углекислого газа. Абсолютно точным уравнение Менделеева-Клапейpона является для идеального газа. Особенностью которого, является то, что его внутренняя энергия пропорциональна абсолютной температуре и не зависит от объема, который газ занимает.
Примеры решения задач
| Задание | Температуру воздуха в комнате повысили от |
| Решение | Если тепловым расширением стен можно пренебречь, то объем комнаты не изменяется. В том, случае, если воздух нагревается при постоянном объеме давление должно расти с увеличением температуры, при этом его плотность не изменяется. Однако комната не является герметичной, поэтому объем газа (воздуха) в помещении постоянным считать нельзя. Постоянным в нашем случае является давление, которое равно наружному давлению атмосферы. При увеличении температуры уменьшается масса воздуха в комнате, так как газ выходит через щели наружу.
Вычислить плотность воздуха, можно используя уравнение Менделеева-Клапейpона: Разделим правую и левую части уравнения (1.1) на V, имеем: Из уравнения (1.2) выразим плотность ( Из выражения (1.3) видно, что при постоянном давлении плотность обратно пропорциональна температуре для одного и того же газа, значит: |
| Ответ |
| Задание | Чему равен вес (P) оболочки воздушного шара, который наполнен водородом, если шарик находится во взвешенном состоянии? Давление внутри шара равно внешнему давлению атмосферы. Радиус шара R. Воздух и водород находятся при нормальных условиях. |
| Решение | Сделаем рисунок.
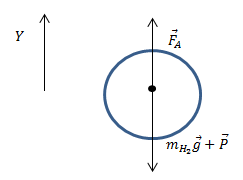
Рис. 1 В соответствии со вторым законом Ньютона для шарика запишем: где ускорение шарика равно нулю, так как по условию шар находится во взвешенном состоянии. В проекции на ось Y (рис.1) имеем: По закону Архимеда: где Применим уравнение Менделеева-Клапейpона для нахождения масс воздуха ( Подставим найденные массы в уравнение (2.4), имеем: где объем шара найден как: |
| Ответ |











