Формула воздуха
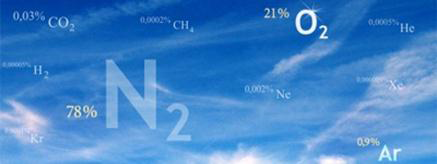
Газовый состав воздуха
От уровня моря до высоты около 11000 м (слой тропосферы) газовый состав воздуха практически не изменяется и выглядит следующим образом:
| Вещество | Формула | Объемная доля, % | Массовая доля, % |
|---|---|---|---|
|
Азот |
N2 |
78,08 |
75,5 |
|
Кислород |
O2 |
20,95 |
23,1 |
|
Аргон |
Ar |
0,93 |
1,29 |
|
CO2 |
0,034 |
0,046 |
|
|
Неон |
Ne |
0,0018 |
0,0014 |
|
Гелий |
He |
0,000524 |
0,000073 |
|
Метан |
CH4 |
0,0002 |
0,000084 |
|
Криптон |
Kr |
0,0001 |
0,003 |
|
H2 |
0,00005 |
0,00008 |
|
|
Ксенон |
Xe |
0,000008 |
0,00004 |
Средняя молярная масса воздуха: 29,16 г/моль
Воздух в тропосфере практически всегда содержит некоторое количество водяного пара. Влажность воздуха зависит от его температуры и высоты над уровнем моря.
Состав воздуха может незначительно меняться в зависимости от географического положения, времени года, времени суток. В крупных городах обычно повышенное содержание углекислого газа. В горах наблюдается более низкое содержание кислорода, из-за того, что кислород тяжелее азота, поэтому его плотность с высотой уменьшается быстрее.
В нижних слоях атмосферы могут содержаться во взвешенном состоянии некоторые количества мелких частиц пыли и золы, которые образуются в процессе горения различных видов топлива или в результате извержения вулканов. С присутствием в воздухе этих высокодисперсных частиц связана окраска солнечных восходов и закатов, обусловленная рассеянием на них солнечных лучей.
Примеры решения задач по теме «формула воздуха»
| Задание | Плотность некоторого газа по воздуху равна 2. Какую массу будет иметь этот газ объемом 5,6 л (н.у.)? |
| Решение | Молекулярная масса воздуха равна 29 г/моль.
Рассчитаем молекулярную массу данного газа:
Согласно следствию из закона Авогадро молярный объем газа при нормальных условиях равен 22,4л. Составим пропорцию и рассчитаем массу 5,6 л газа: 58г газа занимает объем 22,4л х г газа занимает объем 5,6л Отсюда
|
| Ответ | Масса 5,6л газа будет равна 14,5 г. |
| Задание | При сжигании 5,36 г некоторого гомолога бензола было израсходовано 56,7 л воздуха (н.у). Определите формулу исходного соединения. |
| Решение | Запишем уравнение реакции горения:
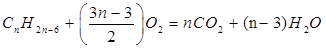
Содержание кислорода в воздухе – 21%. Рассчитаем объем кислорода, израсходованного в процессе горения:
Количество вещества кислорода будет равно:
По уравнению реакции 1 моль CnH2n–6 — (3n–3)/2 моль O2 х моль CnH2n–6 — 0,531моль O2 Отсюда количество вещества гомолога бензола, вступившего в реакцию, будет равно: 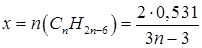
Молярная масса CnH2n–6 равна: 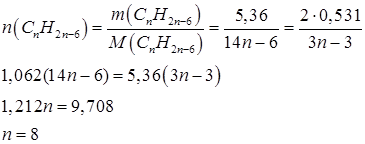
Следовательно, формула вещества C8H10 |
| Ответ | Формула соединения – С8Н10 |











