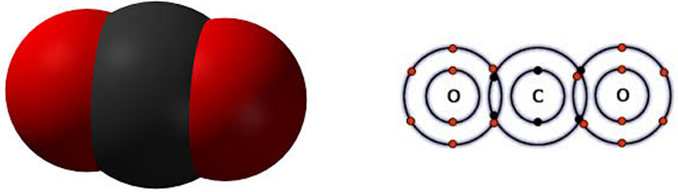
Формула углекислого газа
Химическая, структурная и электронная формулы углекислого газа
Химическая формула: СО2.
Структурная формула: O = C = O
Электронная формула:
Молярная масса: 44,01 г/моль.
Физические свойства углекислого газа
При стандартных условиях – газ без цвета и запаха, с кисловатым вкусом. При атмосферном давлении не существует в жидком состоянии, при сильном охлаждении кристаллизуется в виде «сухого льда» – белой снегообразной массы. Температура сублимации равна –78 °С. При нормальных условиях в одном объеме воды растворяется 0,9 объемов углекислого газа.
Химические свойства углекислого газа
Является кислотным оксидом.
- При растворении в воде образует угольную кислоту:
![Rendered by QuickLaTeX.com \[ CO_{2} + H_{2}O \leftrightarrow H_{2}CO_{3} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ecb0b13a7be84624c2939eb367db297b_l3.png)
- Взаимодействует с основными оксидами и основаниями, образуя карбонаты и гидрокарбонаты (соли угольной кислоты):
![Rendered by QuickLaTeX.com \[ Na_{2}O + CO_{2} \to Na_{2}CO_{3} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e07077d3a3947eeb599575541a411622_l3.png)
![Rendered by QuickLaTeX.com \[ 2KOH + CO_{2} \to K_{2}CO_{3} + H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-84b7dfd888868d549bfdcbb1d081d7fd_l3.png)
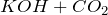 (избыток)
(избыток) 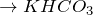
- Не поддерживает горение, но при нагревании может окислять активные металлы:
![Rendered by QuickLaTeX.com \[ CO_{2} + 2Mg \to 2MgO + C \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b16e0a4c40eb30fb426e6e8927d4a4fc_l3.png)
Качественная реакция – помутнение известковой воды (Ca(OH)2) за счет образования белого осадка карбоната кальция:
![]()
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений.
В промышленности углекислый газ получают термическим разложением карбонатов:
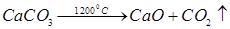
В лаборатории – действием сильных кислот на карбонаты или гидрокарбонаты:
![]()
Примеры решения задач
| Задание | Рассчитать объем углекислого газа (н.у) который можно получить при сжигании 12 тонн угля, если выход продукта составляет 90% от теоретически возможного. |
| Решение | Запишем уравнение реакции горения:
Рассчитаем количество вещества углерода по формуле:
По уравнению реакции
1 моль газа при нормальных условиях занимает объем 22,4л. Рассчитаем теоретический объем углекислого газа:
Рассчитаем практический объем углекислого газа:
|
| Ответ | Объем полученного углекислого газа равен 20160 м |
| Задание | Рассчитать объем 20% раствора соляной кислоты (плотность =1,1 г/мл), который необходим для получения 5,6 литров углекислого газа из образца известняка, который содержит 5% примесей. |
| Решение | Запишем уравнение реакции:
В процессе реакции образуется угольная кислота (H2CO3), которая сразу разлагается на воду (H2O) и углекислый газ (CO2). Рассчитаем количество вещества углекислого газа по формуле: где Vm – молярный объем, т.е. объем, который занимает один моль газа при нормальных условиях. Тогда:
Для расчета количества вещества соляной кислоты составим пропорцию по уравнению реакции: 2 моль HCl приводят к образованию 1 моль CO2 x моль HCl приводят к образованию 0,25 моль CO2 Отсюда:
Молярная масса соляной кислоты равна 36,5 г/моль. Рассчитаем массу соляной кислоты:
Выражение для массовой доли вещества в растворе: Рассчитаем массу раствора соляной кислоты по формуле: 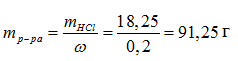
Если раствор HCl 20%, то массовая доля соляной кислоты в нем будет равна 0,20. Рассчитаем объем раствора соляной кислоты по формуле:
|
| Ответ | Объем 20% раствора соляной кислоты равен 82,95 мл. |











