Формула серы
Электронная формула серы
Атомная масса: 32,065 а.е.м.
Электронная формула: 1s2 2s2 2p6 3s23p4

Электронно-графическая формула атома серы
Электронно-графическая формула атома серы в основном и возбужденных состояниях с примерами соединений:
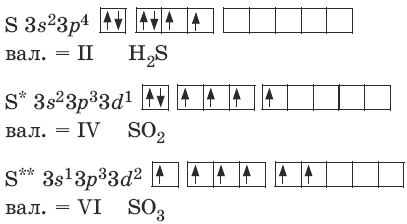
Атомы серы способны образовывать устойчивые цепочки. Такие гомоцепи имеют зигзагообразную форму, поскольку их образуют р-электроны соседних атомов, расположенные на взаимно перпендикулярных орбиталях. Цепи могут открытыми или замыкаться в циклы состава S20, S8, S6 и S 4.
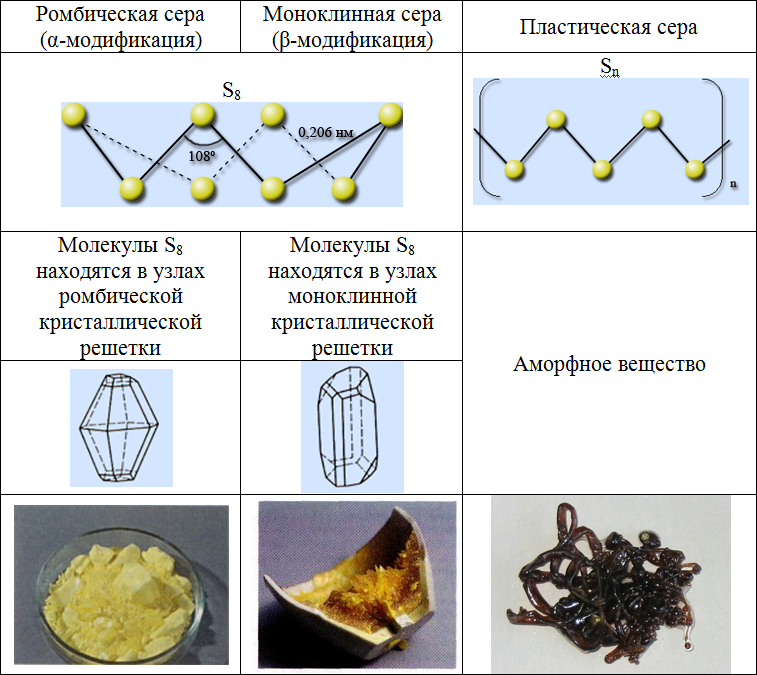
Сера образует несколько десятков кристаллических и аморфных модификаций, которые отличаются составом молекул и полимерных цепей, а также спо собом их упаковки в твердом состоянии.
Основные аллотропные модификации серы:
В природе сера встречается в свободном состоянии (самородная сера) и в виде минералов (FeS2, ZnS, PbS и др.). Сера также присутст вует в нефти, природном угле, сланцах и природном газе. Присутствие сульфат-ионов в воде обуславливает ее постоянную жёсткость. Сера является жизненно важным элементом живых организмов, входит в состав белков.
Примеры решения задач
| Задание | Какая масса серы необходима для взаимодействия с 5,4 г алюминия? |
| Решение | Запишем уравнение реакции:
Найдем количество вещества алюминия:
По уравнению реакции
Масса серы будет равна:
|
| Ответ | Масса серы 9,6г |
| Задание | 6,3 г смеси серы и фосфора обработали избытком концентрированной азотной кислоты, в результате реакции выделилось 24,64 л бурого газа (н.у.). Полученный газ был пропущен через 6,5% раствор гидроксида калия массой 949,4 г. Определите массовые доли полученных солей в растворе и массовые доли серы и фосфора в исходной смеси. |
| Решение | Запишем уравнения реакций.
Взаимодействие серы с концентрированной азотной кислотой: Взаимодействие фосфора с концентрированной азотной кислотой: Количество вещества выделившегося бурого газа равно:
Пусть в исходной смеси содержится х моль серы и у моль фосфора. Составим систему уравнений: Выразим у из второго уравнения и подставим в первое: Рассчитаем массу серы:
Массовая доля серы в смеси будет равна:
Массовая доля фосфора в смеси: Взаимодействие бурого газа (NO2) с гидроксидом калия: Рассчитаем количество вещества гидроксида калия:
По уравнению реакции
Рассчитаем массы солей:
Конечная масса раствора будет равна:
Массовые доли солей в растворе будут равны: |
| Ответ | Массовые доли солей в растворе массовые доли серы и фосфора в смеси |






![Rendered by QuickLaTeX.com \[ \begin{cases} 32x+31y=6,3 \\ 6x+5y=1,1 \end{cases} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0dc5958b491a1ede19ffcf59ff8a75f6_l3.png)





