Формула азота
Атомная масса: 14,008.а.е.м.
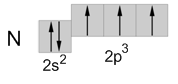
Электронная и графическая формула азота
Электронная формула: 1s2 2s2 2p3.
Электронно-графическая формула внешнего электронного слоя атома азота:
Азот является одним из самых распространенных элементов на Земле, а также одним из основных биогенных элементов, входит в состав белков и нуклеиновых кислот.
Азот – простое вещество, состоящее из двух атомов азота.
Формула: N2.
Структурная формула азота
Структурная формула:

Молярная масса: 28,016 г/моль.
При нормальных условиях азот – бесцветный газ, не имеет запаха, цвета и вкуса, плохо растворим в воде. В жидком состоянии – бесцветная, подвижная жидкость. При контакте с воздухом жидкий азот поглощает из него кислород. В твердом состоянии (−209,86°C) существует в виде снегоподобной массы или больших белоснежных кристаллов.
Молекула азота очень прочная, поскольку между атомами азота в молекуле N2 образуется тройная связь N≡N. Вследствие этого многие соединения азота имеют положительную энтальпию образования (галогениды, азиды, оксиды), а соединения азота термически неустойчивы и довольно легко разлагают ся при нагревании. Химически азот довольно инертен, поэтому в природе находится главным образом в свободном состоянии.
Азот при обычных условиях реагирует только с литием:
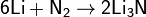
при нагревании может вступить в реакцию с некоторыми другими металлами и неметаллами, также с образованием нитридов:
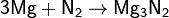
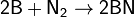
Наибольшее практическое значение имеет аммиак (нитрид водорода) NH3, который получается при взаимодействии водорода с азотом:
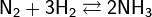
В электрическом разряде азот реагирует с кислородом, образуя оксид азота(II) NO:
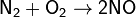
Азот также может образовывать комплексные соединения с переходными металлами.
Примеры решения задач
| Задание | Для получения аммиака провели реакцию между 67,2 м |
| Решение | Запишем уравнение реакции:
Стехиометрическое соотношение объемов реагирующих газов должно быть равно Найдем фактическое соотношение объемов водорода и азота: В фактическом соотношении азота больше, значит, полученный аммиак будет загрязнен азотом |
| Ответ | Аммиак будет загрязнен азотом |
| Задание | Масса 1л смеси азота и водорода при температуре 0°С и давлении 2 атм. равна 1,0 г. Рассчитайте содержание азота в смеси (мольная доля |
| Решение | Воспользуемся уравнением Менделеева-Клапейрона:
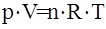
Выразим исходные данные в СИ:
Суммарное количество вещества газов в смеси будет равно: 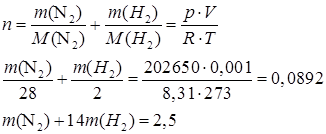
Составим систему уравнений: 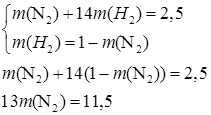
Отсюда
Найдем количество вещества каждого газа в смеси:
Мольная доля азота в смеси будет равна: 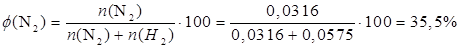
|
| Ответ | Мольная доля азота в смеси равна 35,5% |











