Формула идеального газа
Определение и формулы идеального газа
Допущения модели идеального газа:
- объём частиц газа пренебрежимо мал, молекулы – материальные точки;
- молекулы не взаимодействуют между собой, все столкновения абсолютно упругие;
- время взаимодействия между частицами газа пренебрежимо мало по сравнению со средним временем между столкновениями молекул.
К большинству реальных в довольно широком интервале температур и давлений применима модель идеального газа.
Формулы для идеального газа
Формула, связывающая макроскопические параметры идеального газа, называется уравнением состояния идеального газа или уравнением Менделеева Клапейрона :
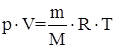
где р – давление, Па; V – объем, м![]() ; m – масса (кг), T – абсолютная температура (К), R – универсальная газовая постоянная, R = 8,314 Дж/(моль • К), М – молярная масса газа (кг/моль).
; m – масса (кг), T – абсолютная температура (К), R – универсальная газовая постоянная, R = 8,314 Дж/(моль • К), М – молярная масса газа (кг/моль).
Если масса газа постоянна, то уравнение состояния можно записать в форме объединенного газового закона:
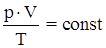
При постоянной температуре объединенный газовый закон переходит в уравнение Бойля Мариотта:
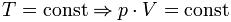
При постоянном давлении объединенный газовый закон переходит в уравнение Гей-Люссака:
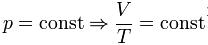
При постоянном объеме объединенный газовый закон переходит в уравнение Шарля:
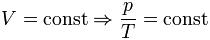
Основное уравнение молекулярно-кинетической теории идеального газа связывает давление газа и среднюю кинетическую энергию его частиц:
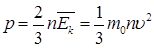
где n – число частиц газа в единице объема, m0 – масса одной частицы, υ – скорость частицы.
Средняя кинетическая энергия частиц и абсолютная температура газа связаны уравнением:
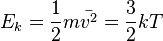
где k = 1,38 • 10−23 Дж/К – постоянная Больцмана.
Примеры решения задач
| Задание | Вычислить молекулярную массу бензола, если 600 мл его паров при температуре 87°C и давлении 83,2 кПа имеют массу 1,30 г. |
| Решение | Запишем уравнение состояния идеального газа:
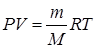
Выразим исходные данные в единицах СИ:
Молярная масса бензола будет равна:
|
| Ответ | Молярная масса бензола равна 78г/моль. |
| Задание | Рассчитайте объем воздуха, который необходим для полного сгорания 25 кг метилэтилового эфира, при температуре – 4° С и давлении 1,2 • 105 Па. |
| Решение | Формула метилэтилового эфира: СН3ОС2Н5
Запишем уравнение реакции горения: Рассчитаем количество вещества метилэтилового эфира.
По уравнению реакции:
По уравнению Менделеева-Клапейрона: 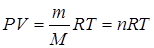
Выразим объем газа: 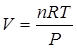
Рассчитаем объем кислорода:
Содержание кислорода в воздухе составляет 20,94 % по объему. Рассчитаем объем воздуха:
|
| Ответ | Объем воздуха равен 167 м |











