Внутренняя энергия идеального газа
Определение и общие сведения о внутренней энергии идеального газа
Она включает энергию, которая возникает, как результат взаимодействия и перемещения частиц, составляющих сложные частицы. К внутренней энергии относят кинетическую энергию, связанную с перемещением центра масс системы (движение системы как целого), потенциальную энергию системы во внешнем поле. Условно считают, что изменение внутренней энергии является положительным, если внутренняя энергия системы растет, и отрицательной, при уменьшении внутренней энергии.
Обычно внутреннюю энергию в термодинамике обозначают буквой U.
В идеальном газе взаимная потенциальная энергия молекул равна нулю, внутренняя энергия его равна сумме кинетических энергий молекул:
![]()
где i – число степеней свободы молекулы идеального газа; m – масса газа; ![]() – молярная масса газа;
– молярная масса газа; ![]() — постоянная Больцмана;
— постоянная Больцмана; ![]() – число Авогадро;
– число Авогадро; ![]() – универсальная газовая постоянная;
– универсальная газовая постоянная; ![]() – количество вещества; T – температура по абсолютной шкале. Внутренняя энергия идеального газа определена его термодинамической температурой (T) и пропорциональна массе.
– количество вещества; T – температура по абсолютной шкале. Внутренняя энергия идеального газа определена его термодинамической температурой (T) и пропорциональна массе.
Внутренняя энергия является функцией состояния, что означает: при любом переходе из одного состояния в другое изменение внутренней энергии (![]() ) будет равно:
) будет равно:
![]()
где ![]() – внутренняя энергия первого состояния системы;
– внутренняя энергия первого состояния системы; ![]() – внутренняя энергия второго состояния.
– внутренняя энергия второго состояния. ![]() не зависит от хода процесса.
не зависит от хода процесса.
Внутренняя энергия смеси из m идеальных газов равна сумме внутренних энергий газов (![]() ), составляющих эту смесь:
), составляющих эту смесь:
![Rendered by QuickLaTeX.com \[U=\sum^m_{i=1}{U_i\ \left(3\right).}\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c4fcd735788574b389dfa6879e347fb5_l3.png)
Внутренняя энергия и первое начало термодинамики
Внутренняя энергия системы может изменяться в результате проведения различных процессов, например, при совершении над системой работы или отведения (подведения) от нее тепла. При превращении энергии выполняется закон сохранения, который в термодинамике носит название первого начала:
![]()
где Q – количество теплоты, полученное системой; A – работа, которую совершает система против внешних сил.
Примеры решения задач
| Задание | Чему равно изменение внутренней энергии в 1) изохорном; 2) изобарном; 3) изотермическом и 4) адиабатном процессах? |
| Решение | 1) В изохорном процессе объем постоянный. 2) При постоянном давлении формула расчета изменения внутренней энергии ( 3) В изотермическом процессе температура идеального газа постоянный параметр системы, получим, что изменение внутренней энергии равно нулю: 4) Адиабатный процесс происходит без подвода или отвода к системе тепла, поэтому из первого начала термодинамики изменение внутренней энергии идеального газа можно найти как: |
| Задание | Какому процессу, происходящему в идеальном газе, соответствует график, представленный на рис.1: 1) изохорному, 2) изобарному, 3) адиабатному, 4) изотермическому?
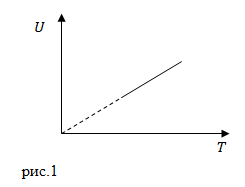
|
| Решение | Внутренняя энергия идеального газа для любого процесса равна:
Получается, что для любого идеального газа, при постоянной массе, внутренняя энергия прямо пропорциональная его температуре. То есть, этот график (рис.1) отображает изменение внутренней энергии для изобарного, изохорного и адиабатного процессов. Для изотермического процесса данный график не подойдет, так как в этом процессе неизменна температура, а на графике она изменяется. |











