Работа идеального газа
Рассмотрим газ, который находится в цилиндре, закрытом поршнем (рис.1).
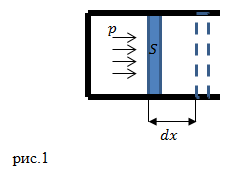
Пусть газ при расширении передвинет поршень на малое расстояние ![]() . Таким образом, газ выполнит работу над поршнем (
. Таким образом, газ выполнит работу над поршнем (![]() ):
):
![]()
где F – сила, с которой газ действует на поршень, S – площадь поршня; p – давление газа на поршень; ![]() – изменение объёма газа под поршнем. Результирующая работа газа, если его объем изменяется от
– изменение объёма газа под поршнем. Результирующая работа газа, если его объем изменяется от ![]() до
до ![]() находится как:
находится как:
![Rendered by QuickLaTeX.com \[A=\int^{V_2}_{V_1}{pdV} \qquad (2)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-307146ee2b5ca3587ed0509196a22027_l3.png)
Более конкретный результат интегрирования определяет зависимость ![]() . Формула (2) для вычисления работы справедлива для изменения объема всех видов тел (газа, жидкости и твердого тела).
. Формула (2) для вычисления работы справедлива для изменения объема всех видов тел (газа, жидкости и твердого тела).
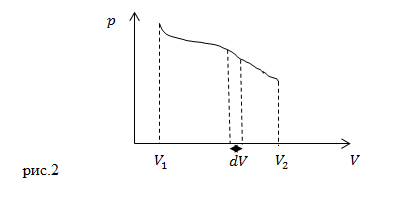
Часто работу газа изображают при помощи графиков в осях ![]() (рис.2). Если объем газа увеличивается на
(рис.2). Если объем газа увеличивается на ![]() , то работа газа (
, то работа газа (![]() ) – это площадь криволинейной трапеции с основанием
) – это площадь криволинейной трапеции с основанием ![]() на рис. 2. Суммарная работа, которую совершил газ, изменяя объем от
на рис. 2. Суммарная работа, которую совершил газ, изменяя объем от ![]() до
до ![]() , определена площадью, которая ограничивается осью абсцисс, кривой
, определена площадью, которая ограничивается осью абсцисс, кривой ![]() и прямыми
и прямыми ![]() и
и ![]() .
.
Работа идеального газа для отдельных процессов
В изобарном процессе (![]() ) работа вычисляется при помощи формулы:
) работа вычисляется при помощи формулы:
![Rendered by QuickLaTeX.com \[A_{p=const}=p\int^{V_2}_{V_1}{dV=p\left(V_2-V_1\right)} \qquad (3)\]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-fe5676918253ce4d339056f88171b922_l3.png)
В изохорном процессе работа газа равна нулю, так как изменения объема не происходит:
![]()
Найдем работу для изотермического процесса (![]() ):
):
![]()
где из уравнения Менделеева – Клапейрона: ![]() – молярная масса газа; m – масса газа). Получили, что для изотермического процесса работа равна:
– молярная масса газа; m – масса газа). Получили, что для изотермического процесса работа равна:
![]()
Для адиабатного процесса, который проходит без обмена теплом окружающей среды и газа работу проще найти из первого начала термодинамики:
![]()
Так как ![]() то получаем, что в адиабатном процессе газ выполняется работу за счет уменьшения внутренней энергии:
то получаем, что в адиабатном процессе газ выполняется работу за счет уменьшения внутренней энергии:
![]()
где i – число степеней свободы молекулы газа.
Примеры решения задач
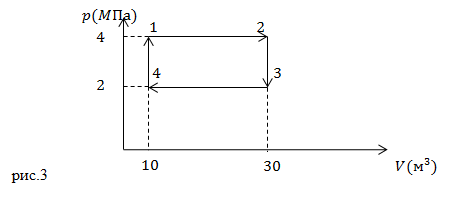
| Задание | Чему равна работа, которая совершается в круговом процессе, изображенном на рис.3?
|
| Решение | В представленном цикле 1-2-3-4 изменение объема газа происходит в процессах: 1-2 и 3-4. Процессы 2-3 и 4-2 протекают при постоянном объеме. В процессе 1-2 объем газа увеличивается, это значит, что газ совершает работу ( Мы знаем, что работу можно трактовать как площади, в нашем случае, площади прямоугольников: где где Результирующая работа равна: Работу в цикле можно было найти сразу как площадь фигуры, которая определена кривой цикла, в нашем случае это площадь прямоугольника 1-2-3-4: |
| Ответ |
| Задание | Какое количество теплоты подводят к идеальному двухатомному газу ( |
| Решение | 1) Для изотермического процесса первое начало термодинамики:
преобразуется к виду: так как при T=const внутренняя энергия идеального газа не изменяется. В изотермическом процессе к газу подводят 2 кДж теплоты. 2) Для изобарного расширения. Чтобы найти количество теплоты, подводимое системе, снова воспользуемся первым началом термодинамики (2.1). Работа нам известна, нужно найти изменение внутренней энергии газа. Мы знаем, что в изобарном процессе: Из уравнения Менделеева – Клапейрона (учитывая, что Сравнивая выражения (2.3) и (2.4), получим: Тогда изменение внутренней энергии в нашем процессе ( Подставим (2.6) в (2.1), получим: Вычислим |
| Ответ |











