Формула кислорода
Определение и формула кислорода
Атомная масса: 15,9994 а.е.м.
Электронная формула: 1s2 2s2 2p4
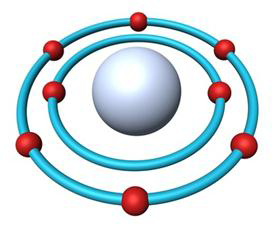
Кислород – самый распространённый элемент в земной коре (47 % массы). Морские и пресные воды содержат 85,82 %(по массе) связанного кислорода. Содержание свободного кислорода в атмосфере составляет 20,95% по объёму и 23,10 % по массе. Кислород входит в состав молекул многих органических веществ. Число атомов кислорода в живых клетках составляет около 25 %, массовая доля кислорода в живых организмах – около 65 %.
Кислород существует в виде двухаллотропных модификаций – кислорода и озона.
Кислород (дикислород) – простое вещество, состоящее из двух атомов кислорода.
Формула: O2.
Структурная формула кислорода

Молярная масса: 31,998 г/моль.
Кислород при нормальных условиях – газ без цвета, вкуса и запаха. В жидком состоянии кислород светло-голубого цвета, а в твердом – светло-синие кристаллы.
Озон – простое вещество, состоящее из трех атомов кислорода.
Формула: O3.
Структурная формула:

Молярная масса: 47,998 г/моль
При нормальных условиях озон – сине-голубой газ с характерным резким запахом. В жидком состоянии – темно-фиолетового цвета (цвета индиго). В твердом виде – черные кристаллы с фиолетовым отблеском.
Озон присутствует в атмосфере, в так называемом озоновом слое, где он образуется из кислорода под действием ультрафиолетового излучения или грозовых разрядов:
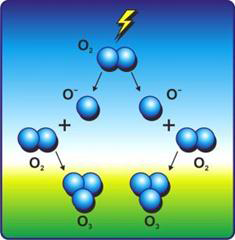
Примеры решения задач
| Задание | Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,173 г одного из галогенов. Определите эквивалент галогена. |
| Решение | Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
По закону эквивалентов: 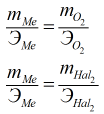
Эквивалентная масса кислорода ЭО2 Выразим эквивалентную массу галогена: 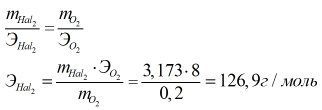
Галоген – йод. |
| Ответ | Галоген – йод. |
| Задание | Через растворы |
| Решение | Запишем уравнения процессов, происходящих при электролизе каждого раствора.
Электролиз раствора NiSO4 Катод: Ni2++ 2ē Анод: 2Н2О – 4ē = О2 + 4Н+ окисление воды с выделением кислорода Электролиз раствора РbSO4 Катод: Pb2++ 2ē Анод: 2Н2О – 4ē = О2 + 4Н+ окисление воды с выделением кислорода По закону Фарадея: 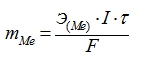
где I – сила тока при электролизе, А; t – продолжительность электролиза, с; F – число Фарадея, F = 96500 Кл/моль, ЭМе – эквивалентная масса металла. Поскольку через растворы NiSO4 и РbSO4 было пропущено одинаковое количество электричества, то 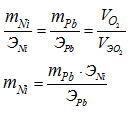
Э Э
Тогда масса никеля, выделившегося на катоде, будет равна: 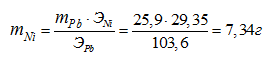
Объем кислорода, выделившегося на каждом из анодов, будет равен: 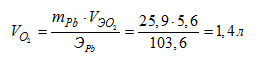
|
| Ответ | На катоде выделилось 7,34 г никеля; на каждом аноде выделилось 1,4л кислорода. |











