Формула серной кислоты
Химическая и структурная формула серной кислоты
Химическая формула: H2SO4
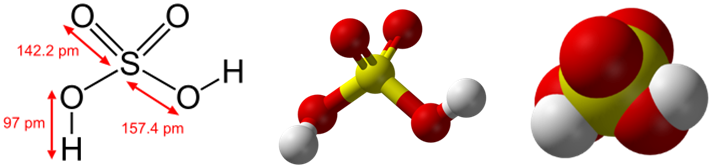
Молекулярная масса: 98,078г/моль.
Физические свойства серной кислоты
При обычных условиях – тяжёлая маслянистая жидкость без цвета и запаха (может иметь желтоватый оттенок), с кислым «медным» вкусом. Температура кристаллизации чистой серной кислоты +10°С.
Неограниченно смешивается с водой с выделением большого количества тепла, поэтому во избежание «вскипания» раствора всегда следует добавлять серную кислоту в воду, а не наоборот.

Раствор SO3 в серной кислоте называется олеум. Олеум содержит пиросерные кислоты, образующиеся по реакциям:
![]()
![]()
Серная кислота – сильная кислота, константа диссоциации Ка = 103. Образует средние и кислые соли – сульфаты и гидросульфаты.
Химические свойства серной кислоты
Разбавленная серная кислота проявляет типичные свойства кислот:
- реагирует с металлами, находящимися в электрохимическом ряду напряжений до водорода с образованием сульфатов и выделением водорода:
![Rendered by QuickLaTeX.com \[ Zn + H_{2}SO_{4} = ZnSO_{4} + H_{2} \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-06b8e06ef90189cc189d8b56cf3a8963_l3.png)
- реагирует с основными оксидами:
![Rendered by QuickLaTeX.com \[ MgO + H_{2}SO_{4} = MgSO_{4} + H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-dea2362f560ad53253d4b19e999a4d82_l3.png)
- и с основаниями с образованием соответствующей соли и воды:
![Rendered by QuickLaTeX.com \[ 2NaOH + H_{2}SO_{4} = Na_{2}SO_{4} + 2H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-041c46784fd7084229eac93a1a11504c_l3.png)
- вытесняет более слабые кислоты из их солей:
![Rendered by QuickLaTeX.com \[ H_{2}SO_{4} + CH_{3}COONa \to NaHSO_{4} + CH_{3}COOH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-087bdecab300cc52cf7d63ed95d49401_l3.png)
Концентрированная серная активно поглощает пары воды, способна вытеснять воду из органических соединений, с образованием углерода, воды и выделением тепла (обугливание сахара):
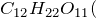 сахароза
сахароза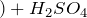 (конц)
(конц)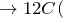 уголь
уголь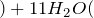 пар
пар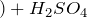
Концентрированная серная кислота – очень сильный окислитель:
- окисляет металлы, вне зависимости от их положения в ряду напряжений (кроме золота и платины) восстанавливаясь при этом до SO2. Выделения водорода не происходит.
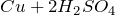 (конц)
(конц)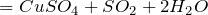
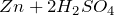 (конц)
(конц)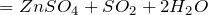
- реагирует с неметаллами:
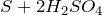 (конц)
(конц)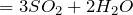
- с оксидами неметаллов:
![Rendered by QuickLaTeX.com \[ CO + H_{2}SO_{4} = CO_{2} + SO_{2} + H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-89920b52bd551eb215f806888484cfda_l3.png)
- с кислотами – неокислителями:
![Rendered by QuickLaTeX.com \[ 2HCl + H_{2}SO_{4} = Cl_{2} + SO_{2} + 2H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d715cef896d9e003683733eb8bf231a9_l3.png)
Качественная реакция на сульфат-ион – взаимодействие с растворимыми солями бария, с образованием нерастворимого в воде и кислотах белого осадка сульфата бария:
![]()

|
Концентрированная серная кислота – очень едкое вещество. При попадании на живые ткани дегидрирует углеводороды, выделяя избыточное тепло, что приводит к вторичному термическому ожогу, дополнительно к химическому ожогу. Поэтому повреждения, вызываемые серной кислотой, потенциально более опасны, чем повреждения, вызванные другими кислотами. |
Примеры решения задач
| Задание | Рассчитать, сколько мл 96%-ного раствора серной кислоты с плотностью 1,8355 г/см |
| Решение | Масса серной кислоты в 1 л 30%-ного раствора равна:
Масса серной кислоты в 1 мл 96%-ного раствора равна:
Объем 96%-ного раствора серной кислоты будет равен:
|
| Ответ | 207,55 мл 96%-ного раствора H2SO4. |
| Задание | К 3 л воды прибавили 2 мл 96% серной кислоты, плотность которой равна 1,84 г/мл. Вычислить pH полученного раствора. |
| Решение | Серная кислота – сильная кислота, в растворе полностью диссоциирует на ионы:
Рассчитаем массу раствора серной кислоты:
Рассчитаем массу серной кислоты в растворе:
Молярная масса серной кислоты равна 98 г/моль. Найдем количество вещества серной кислоты в растворе:
Суммарный объем раствора будет равен:
Рассчитаем молярную концентрацию серной кислоты:
Из уравнения реакции диссоциации серной кислоты следует, что концентрация ионов водорода равна:
Вычислим pH полученного раствора: |
| Ответ | рН полученного раствора серной кислоты равен 1,62. |











