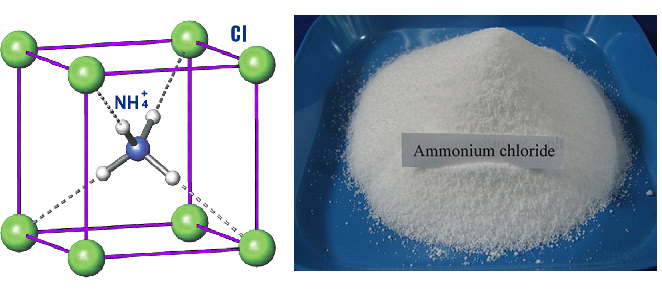
Формула хлорида аммония
Определение и формула хлорида аммония
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белое порошкообразное летучее термически малоустойчивое вещество.
Хорошо растворяется в воде (гидролиз по катиону).
Химические свойства хлорида аммония
- Разлагается при температуре выше
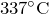 . Процесс протекает по уравнению:
. Процесс протекает по уравнению:
![Rendered by QuickLaTeX.com \[ NH_4Cl =NH_3+HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-edc12df813d02b2fe378019bc4c4515e_l3.png)
- Данная соль реагирует с горячей концентрированной серной кислотой:
![Rendered by QuickLaTeX.com \[ 2NH_4Cl + H_2SO_4 = \left ( NH_4 \right )_2SO_4 + 2HCl \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-61dbb1960cac42bb726f54d8c647c229_l3.png)
- Вступает в химическое взаимодействие с горячими щелочами:
![Rendered by QuickLaTeX.com \[ NH_4Cl + NaOH=NaCl+NH_3 \uparrow +H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-86fc28603af3b10ac0dd86d416bfcdb9_l3.png)
- Может принимать участие в окислительно-восстановительных реакциях с магнием:
![Rendered by QuickLaTeX.com \[ 2NH_4Cl + Mg=MgCl_2 +H_2 \uparrow +2NH_3 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-abb889c7ee0de22d285edf915ec3aaf1_l3.png)
Получение
Хлорид аммония можно получить по реакции обмена между гидроксидом аммония и разбавленным раствором соляной кислоты:
![]()
Применение
Хлорид аммония применяют в качестве азотного удобрения, в пищевой промышленности как добавка E510. Также находит применение в медицине.
Примеры решения задач
| Задание | Рассчитайте сколько теплоты выделится или поглотится при разбавлении насыщенного раствора |
| Решение | Запишем термодинамический цикл:
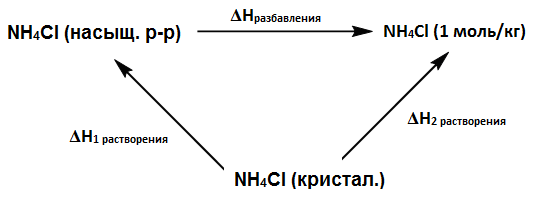
По циклу имеем: Величины |
| Ответ | |
| Задание | Какова энтальпия сольватации |
| Решение | Процесс растворения кристаллического вещества можно разбить на две стадии:
1) Разрушение кристаллической решетки на составляющие ионы. 2) Сольватация ионов кристаллической решетки. Составим термодинамический цикл: 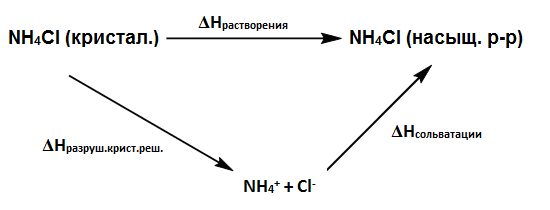
Из цикла имеем: Величины |
| Ответ | |











