Формула гидроксида аммония
Определение и формула гидроксида аммония
Формула – ![]() или
или ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветная жидкость, обладающая резким запахом.
Гидроксид аммония – слабое основание, константа диссоциации ![]() .
.
Диссоциация протекает согласно уравнению:
![]()
Химические свойства гидроксида аммония
- Гидроксид аммония термически неустойчивый и при кипячении раствора происходит выделение аммиака:
![Rendered by QuickLaTeX.com \[ NH_4OH=NH_3\uparrow +H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4d8ce7b348c0b1b6fcdaab8cba31b08b_l3.png)
- Достаточно реакционноспособный, обладает восстановительными свойствами. Вступает в реакции обмена:
![Rendered by QuickLaTeX.com \[ NH_4OH+HNO_3\rightarrow NH_4NO_3+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a9375779aad983997f1058c2be121f1d_l3.png)
- Качественной реакцией на гидрат аммиака является образование бурого осадка с
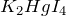 :
:
![Rendered by QuickLaTeX.com \[ 4NH_4OH+2K_2HgI_4\rightarrow \left(Hg_2N\right)I\cdot H_2O\downarrow+4KI+3NH_4I+3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-08185bbdb38eda910ef878807d65131f_l3.png)
В основе способа получения гидроксида аммония лежит реакция газообразного аммиака и воды:
![]()
Применение
Разбавленные растворы аммиака (![]() —
— ![]() ) называют нашатырным спиртом и используют в медицине, концентрированные растворы (
) называют нашатырным спиртом и используют в медицине, концентрированные растворы (![]() —
— ![]() ) — аммиачной водой. В пищевой промышленности зарегистрирован в качестве пищевой добавки E527. В сельском хозяйстве находит применение в качестве удобрения. Аммиачная вода используется для получения солей аммония (азотные удобрения), в производстве соды, красителей.
) — аммиачной водой. В пищевой промышленности зарегистрирован в качестве пищевой добавки E527. В сельском хозяйстве находит применение в качестве удобрения. Аммиачная вода используется для получения солей аммония (азотные удобрения), в производстве соды, красителей.
Примеры решения задач
| Задание | Рассчитайте |
| Решение | Запишем выражение для расчета молярной концентрации раствора:
где В формулу необходимо подставить плотность раствора в г/л, но поскольку в справочниках приводятся данные в г/мл, то умножим выражение на 1000: Подставим численные значения в полученную формулу: Теперь запишем уравнение диссоциации Пусть Запишем выражение для константы диссоциации: Численное значение Поскольку Найдем концентрацию гидроксид-ионов: Вычислим Рассчитаем |
| Ответ | |
| Задание | Какова массовая доля гидроксида аммония в растворе, который образуется при растворении |
| Решение | Стандартные условия — это Рассчитаем количество R — универсальная газовая постоянная, Выразим и вычислим из данного выражения количество моль аммиака: Рассчитаем массу Теперь найдем массу Нам дано, что Тогда, Найдем массу раствора: Вычислим массовую долю гидроксида аммония: |
| Ответ | Массовая доля гидроксида аммония равна |











