Формула гидроксида натрия
Определение и формула гидроксида натрия
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
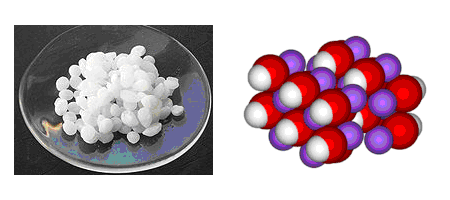
Физические свойства – твердое вещество белого цвета, гигроскопичный. Плавится и кипит без разложения.
Очень хорошо растворяется в воде, создавая сильнощелочную среду, и данный процесс характеризуется большим выделением теплоты.
Химические свойства гидроксида натрия
- Гидроксид натрия проявляет свойства основных гидроксидов, поэтому он реагирует с кислотами:
![Rendered by QuickLaTeX.com \[ 2NaOH+H_2SO_4=Na_2SO_4+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-93601d71f546f90271ad042c3dbfa424_l3.png)
- Горячий раствор вступает в окислительно-восстановительное взаимодействие с галогенами, например:
![Rendered by QuickLaTeX.com \[ 6NaOH+3Cl_2=NaClO_3+5NaCl+3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-07cf976502aa09105b49f0ffc0c3a92e_l3.png)
- Гидроксид натрия также реагирует с кислотными оксидами с образованием солей:
![Rendered by QuickLaTeX.com \[ 2NaOH + SO_2=Na_2SO_3 +H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e30c17d80699e8a19a341bfe72422841_l3.png)
- Реагирует при сплавлении
 с оксидом алюминия:
с оксидом алюминия:
![Rendered by QuickLaTeX.com \[ 2NaOH + Al_2O_3=2NaAlO_2+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b693105f4546f8113dcd682097ede0df_l3.png)
- В растворе реагирует с гидроксидом алюминия:
![Rendered by QuickLaTeX.com \[ NaOH + Al\left ( OH \right )_3=Na\left [ Al\left ( OH \right )_4 \right ] \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e27dfb9be61a66d1ae46015f87a6442b_l3.png)
Получение
Известно большое количество способов получения гидроксида натрия. Одним из них является известковый метод. В его основе лежит реакция раствора карбоната натрия с гидроксидом кальция при небольшом нагревании:
![]()
Ферритный способ получения основывается на химической реакции спекания карбоната натрия с оксидом железа (III) при высокой температуре, и последующей обработке продукта водой:
![]()
![]()
Качественное обнаружение
Ионы натрия можно обнаружить по изменению окраски пламени на желтую.
Кроме того специфической реакцией на ионы натрия является образование белого осадка фторида натрия в холодной воде:
![]()
Применение гидроксида натрия
Гидроксид натрия находит весьма существенное применение во многих отраслях промышленности:
в производстве бумаги, моющих средств, для нейтрализации кислот, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для изготовления биодизельного топлива, приготовления пищи и многое другое.
Примеры решения задач
| Задание | Рассчитайте такое массовое соотношение |
| Решение | Если на
Таким образом, |
| Ответ |
| Задание | Вычислите |
| Решение | Запишем уравнение электролитической диссоциации NaOH в водном растворе:
Из уравнения диссоциации следует, что :
Рассчитаем Вычислим Для этого рассчитаем ионную силу раствора: где Найдем коэффициент активности Определим активность гидроксид-ионов: Тогда |
| Ответ |











