Формула соляной кислоты
Определение и формула соляной кислоты

Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветная едкая жидкость, на воздухе «дымит».
Техническая соляная кислота имеет желтый цвет из-за наличия примесей железа, хлора и других веществ ![]() .
.
Максимальная концентрация в растворе при ![]() равна 38%, плотность этого раствора
равна 38%, плотность этого раствора ![]() г/см
г/см![]() . Молярная масса
. Молярная масса ![]() г/моль.
г/моль.
Соляная кислота – сильная одноосновная кислота, константа диссоциации ![]() . Образует соли – хлориды.
. Образует соли – хлориды.
Химические свойства соляной кислоты
- Взаимодействует с металлами, находящимися в электрохимическом ряду напряжений до водорода с образованием соответствующих хлоридов и выделением водорода:
![Rendered by QuickLaTeX.com \[ Zn + 2HCl = ZnCl_2 + H_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-84b8413222d6ecae884b3efe7762c3aa_l3.png)
- Взаимодействует с оксидами металлов с образованием растворимых солей и воды:
![Rendered by QuickLaTeX.com \[ MgO + 2HCl = MgCl_2 + H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-21bbc74e7270561c824926d3db08b062_l3.png)
- Взаимодействует с гидроксидами металлов с образованием растворимых хлоридов и воды:
![Rendered by QuickLaTeX.com \[ Al(OH)_3 + 3HCl = AlCl_3 + 3H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2c5ae4fff25455d14f738b724773db8f_l3.png)
- Взаимодействует с солями металлов, образованных более слабыми кислотами:
![Rendered by QuickLaTeX.com \[ Na_{2}CO_{3} + 2HCl = 2NaCl + H_{2}O + CO_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-50caa21be69c359375cd23649502e043_l3.png)
- Реагирует с сильными окислителями (перманганатом калия, диоксидом марганца) с выделением хлора:
![Rendered by QuickLaTeX.com \[ 2KMnO_4 + 16HCl = 5Cl_2 \uparrow + 2MnCl_2 + 2KCl + 8 H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-166e770485b9de9d43acc6c3e8f5a765_l3.png)
- Реагирует с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
![Rendered by QuickLaTeX.com \[ NH_3 + HCl = NH_{4}Cl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-070257b24d764733dc39c443652ac335_l3.png)
Качественной реакцией на соляную кислоту и её соли является реакция с нитратом серебра, в результате которой образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
![]()
Получают соляную кислоту растворением газообразного хлороводорода в воде.
Применение
Соляная кислота применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при паянии и лужении, для получения хлоридов металлов (цинка, марганца, железа и др.). Смеси соляной кислоты с ПАВ используются для очистки керамических и металлических изделий от загрязнений и дезинфекции.
В пищевой промышленности соляная кислота используется в качестве регулятора кислотности ![]() , пищевой добавки
, пищевой добавки ![]() . Является естественной составной частью желудочного сока человека.
. Является естественной составной частью желудочного сока человека.
Концентрированная соляная кислота – едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание кислоты в глаза. Для нейтрализации ожогов применяют раствор слабой щёлочи (питьевой соды).
Примеры решения задач
| Задание | Вычислить нормальность раствора соляной кислоты, если на титрование |
| Решение | Запишем уравнение реакции титрования:
Запишем закон эквивалентов для данного процесса титрования: Выразим нормальную концентрацию раствора соляной кислоты: |
| Ответ | Нормальность раствора соляной кислоты равна |
| Задание | Раствор соляной кислоты |
| Решение | Запишем уравнение диссоциации соляной кислоты:
Найдем массу исходного раствора соляной кислоты по формуле: где
Найдем массу соляной кислоты в растворе. Выражение для массовой доли вещества в растворе: Если раствор соляной кислоты 36%, то массовая доля соляной кислоты в нем будет равна Выразим массу соляной кислоты: Учитывая, что молярная масса соляной кислоты равна
Поскольку исходный объем раствора разбавили водой до 1 л, найдем молярную концентрацию полученного раствора соляной кислоты по формуле:
Соляная кислота является сильной кислотой, диссоциирует в водном растворе полностью, поэтому концентрация ионов водорода будет равна концентрации кислоты:
рН раствора рассчитывается по формуле:
|
| Ответ | рН полученного раствора равен 1,678 |






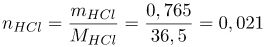 моль
моль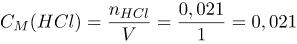 моль/л
моль/л




