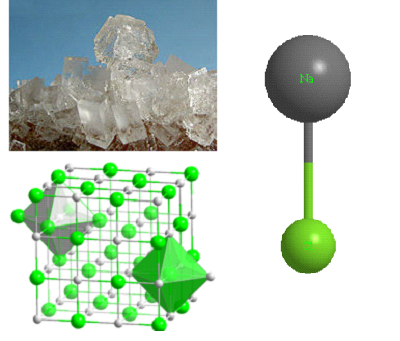
Формула хлорида натрия
Определение и формула хлорида натрия
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – в отсутствие примесей прозрачные бесцветные кристаллы с кубической гранецентрированной решеткой.
Слабогигроскопичный, гигроскопичность резко повышается в присутствии естественных примесей, например солей магния.
Плавится и кипит без разложения.
Умеренно растворяется в воде (не гидролизуется).
Растворимость слабо зависит от температуры, но сильно снижается в присутствии соляной кислоты, гидроксида натрия, хлоридов металлов.
Растворяется в жидком аммиаке.
Хлорид натрия является главной составной частью природных залежей каменной соли, сильвинита, рапы соляных озер.
Химические свойства хлорида натрия
- Хлорид натрия вступает в реакции обмена с кислотами:
![Rendered by QuickLaTeX.com \[ 2NaCl+H_2SO_4=Na_2SO_4+2HCl \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ec19e2fa91321aad892083cb8c7e4530_l3.png)
- Взаимодействует с солями. Необходимое условие протекания реакции: выпадение осадка нерастворимой соли:
![Rendered by QuickLaTeX.com \[ NaCl+AgNO_3=NaNO_3+AgCl \downarrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-374d4d7d48674911a8a14d813730fc3b_l3.png)
- Проявляет слабые восстановительные свойства:
![Rendered by QuickLaTeX.com \[ 2NaCl+2H_2SO_4+MnO_2=Cl_2 \uparrow +MnSO_4+Na_2SO_4+2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7ce314e455831d29be75152d165e6f19_l3.png)
Получение
Хлорид натрия можно получить реакцией обмена:
![]()
При взаимодействии карбоната натрия и соляной кислоты:
![]()
При действии соляной кислоты на металлический натрий:
![]()
Применение
Хлорид натрия является важнейшим пищевым продуктом, служит для консервирования мяса. ![]() — один из главных видов химического сырья и применяется для получения
— один из главных видов химического сырья и применяется для получения ![]() ,
, ![]() , соды, сульфата натрия.
, соды, сульфата натрия.
Примеры решения задач
| Задание | Изобразите валентные возможности атома натрия и хлора при образовании молекулы |
| Решение | Изобразим электронные и электронно-графические формулы 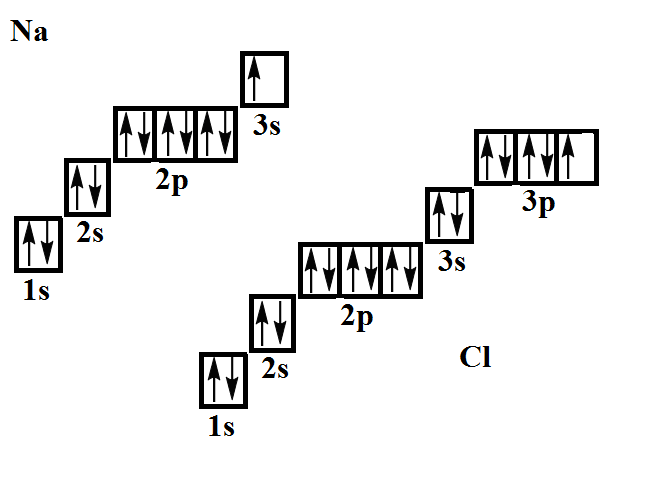
Изобразим спаривание непарных электронов натрия и хлора при образовании молекулы 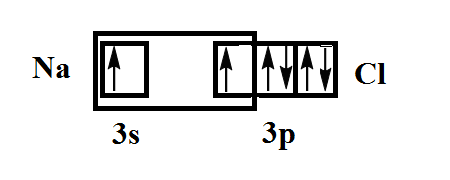
В итоге имеем полностью заполненный энергетический уровень: 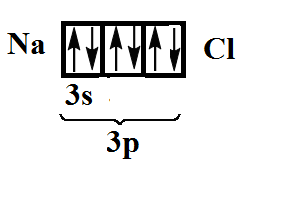
|
| Ответ | Таким образом, между натрием и хлором происходит образование одной одинарной связи. |
| Задание | Рассчитайте осмотическое давление изотонического раствора |
| Решение | Изотонический раствор хлорида натрия — это раствор с массовой долей Плотность Молярная масса хлорида натрия равна: Подставим численные значения в формулу: Так как хлорид натрия сильный электролит и диссоциирует нацело: то, следует учесть изотонический коэффициент Найдем осмотическое давление: Подставляя известные величины получим: |
| Ответ |











