Формула сульфата бериллия
Определение и формула сульфата бериллия
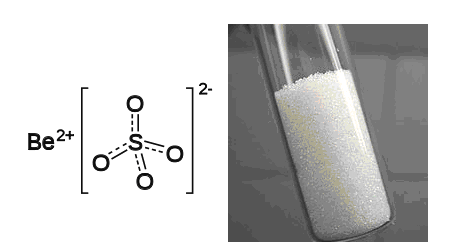
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белые кристаллы, плавящиеся без разложения.
Обычно образует кристаллогидрат с формулой ![]() .
.
Впервые был выделен Берцелиусом в 1815 году.
Химические свойства сульфата бериллия
- Сульфат бериллия хорошо растворяется в подкисленной серной кислотой воде. При этом протекает гидролиз по катиону:
![Rendered by QuickLaTeX.com \[ BeSO_4+4H_2O=\left [ Be\left ( H_2O \right )_4^ \right ]^{2+}+SO_4^{2-} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a934c1af51da9012ab72d71a666297c1_l3.png)
![Rendered by QuickLaTeX.com \[ \left [ Be\left ( H_2O \right )_4 \right ]^{2+}+H_2O\rightleftharpoons \left [ Be\left ( H_2O \right )_3 \left ( OH \right )\right ]^{+}+H_3O^+ \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e7e8c53da4bfd540920e8ca114d28331_l3.png)
- При нагревании до температуры
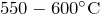 разлагается на оксид бериллия и оксид серы
разлагается на оксид бериллия и оксид серы 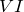 :
:
![Rendered by QuickLaTeX.com \[ BeSO_4=BeO+SO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3a6175625b9ca00715ea7f1d665900dd_l3.png)
- Не растворяется концентрированной серной кислоте. Реагирует с кипящей водой:
![Rendered by QuickLaTeX.com \[ BeSO_4+2H_2O=Be_2SO_4\left ( OH \right )_2 \downarrow H_2SO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d849efabdd79cae7c2fab8fc9b826893_l3.png)
- Взаимодействует с разбавленными щелочами:
![Rendered by QuickLaTeX.com \[ BeSO_4+2NaOH=Be\left ( OH \right )_2 \downarrow +Na_2SO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-27e2c0c8d2c1a2f6dbdb3928f047d042_l3.png)
- Вступает в реакции с концентрированными щелочами:
![Rendered by QuickLaTeX.com \[ BeSO_4+4NaOH=Na_2\left [ Be\left ( OH \right )_4 \right ]+Na_2SO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b77d45bd4dc17353520a40a9675a0462_l3.png)
- Реагирует с гидроксидом аммония:
![Rendered by QuickLaTeX.com \[ BeSO_4+2NH_4OH=Be\left ( OH \right )_2 \downarrow+\left ( NH_4 \right )_2SO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-98bdf567a4b46b810b5cb9826b7c0e4f_l3.png)
Получение
Сульфат бериллия можно получить при взаимодействии любой соли бериллия или оксида бериллия с концентрированной серной кислотой:
![]()
![]()
Применение
Cульфат бериллия в смеси с сульфатом радия использовалась в качестве источника нейтронов в атомных реакторах. Также находит применение в гомеопатии.
Примеры решения задач
| Задание | При растворении |
| Решение | Запишем уравнение химического взаимодействия:
Рассчитаем количество моль
По уравнению реакции из 1 моль гидроксида бериллия образуется 1 моль сульфата бериллия, тогда
Вычислим массу сульфата бериллия
Найдем массу воды в кристаллогидрате:
Вычислим количество моль
Определим количество молекул На На 1 молекулу Из пропорции находим: Следовательно, |
| Ответ |
| Задание | Рассчитайте массовую и мольную доли сульфата бериллия в его кристаллогидрате |
| Решение | Из формулы кристаллогидрата следует, что в 1 моль Вычислим массу
Определим массовую долю |
| Ответ |











