Формула гидроксида алюминия
Определение и формула гидроксида алюминия
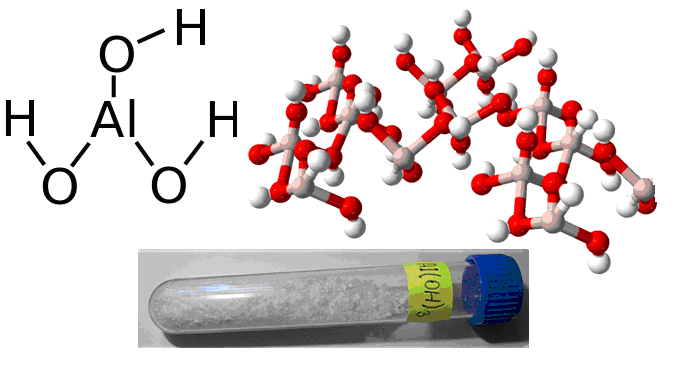
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белое термически неустойчивое вещество не растворяющееся в воде.
Химические свойства гидроксида алюминия
- Гидроксид алюминия при нагревании (
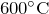 ) разлагается на оксид алюминия и воду:
) разлагается на оксид алюминия и воду:
![Rendered by QuickLaTeX.com \[ 2Al\left ( OH \right )_3=Al_2O_3+3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4361b31eeeb6b0d22b1d805bd0c38c3a_l3.png)
- Проявляет амфотерные свойства, реагируя как с кислотами:
![Rendered by QuickLaTeX.com \[ Al\left ( OH \right )_3 + 3HCl=AlCl_3+3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bbb95524b1c4fe8245835401b565cf6c_l3.png)
так и с щелочами в растворе:
![Rendered by QuickLaTeX.com \[ Al\left ( OH \right )_3 + NaOH=Na\left [ Al\left ( OH \right )_4 \right ] \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-226c02fe3c67421500c7e6a7da5d01b5_l3.png)
и с щелочами при сплавлении (
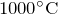 ):
): ![Rendered by QuickLaTeX.com \[ Al\left ( OH \right )_3 + NaOH=NaAlO_2 + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f1b6a52409b804f2ecdba69e98a74b00_l3.png)
- Вступает в химическое взаимодействие с с плавиковой кислотой:
![Rendered by QuickLaTeX.com \[ Al\left ( OH \right )_3+3HF+3NaF=Na_3\left [ AlF_6 \right ]\downarrow +3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8dd2a39699f07cb66add4cd6406d499b_l3.png)
Получение
Гидроксид алюминия можно получить при взаимодействии сульфата алюминия-калия с гидроксидом калия
![]()
Другой способ получения основывается на химической реакции обмена между хлоридом алюминия и гидроксидом аммония:
![]()
Применение
Гидроксид алюминия применяется для очистки воды, поскольку может адсорбировать разнообразные вещества.
Также используется в медицине, в качестве антацидного средства, при изготовлении вакцин.
Применяется в качестве антипирена в пластмассах.
Примеры решения задач
| Задание | Какова массовая доля |
| Решение | Молярную растворимость Тогда, равновесная концентрация ионов а равновесная концентрация гидроксид-анионов Запишем выражение для определения произведения растворимости Из справочника найдем, что : Выразим из данного выражения Так как из 1 моль гидроксида алюминия образуется 1 моль ионов Пересчитаем молярность в массовую долю, приняв плотность раствора за единицу, так как концентрация раствора мала: |
| Ответ |
| Задание | К 20 граммам 10%-ного раствора хлорида алюминия прилили 20 грамм 10%-ного раствора гидроксида натрия. Какое из реагирующих веществ находится в недостатке? |
| Решение | Запишем уравнение взаимодействия хлорида алюминия и гидроксида натрия:
Исходя из уравнения определим количество моль хлорида алюминия: Найдем количество моль гидроксида натрия: Таким образом, хлорид алюминия находится в недостатке. |
| Ответ | Хлорид алюминия. |











