Формула гидроксида бария
Определение и формула гидроксида бария
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белое порошкообразное вещество, хорошо растворимое в воде.
Плавление происходит без разложения, если дальше повышать температуру то разлагается разлагается.
Хорошо растворим в воде с образованием сильнощелочного раствора.
Химические свойства гидроксида бария
- Гидроксид бария при нагревании
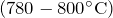 разлагается на окись бария и воду:
разлагается на окись бария и воду:
![Rendered by QuickLaTeX.com \[ Ba\left ( OH \right )_2=BaO+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-68b0c8085723f5a3987e3b711ebbf086_l3.png)
- Проявляет основные свойства, реагируя с кислотами:
![Rendered by QuickLaTeX.com \[ Ba\left ( OH \right )_2 + 2HCl=BaCl_2+2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8faa39cf0e9793551f883decb11dff3b_l3.png)
![Rendered by QuickLaTeX.com \[ Ba(OH)_2 + H_2SO_4 = BaSO_4 \downarrow + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-acf22990243f3dcf4de3b2d3b18c875f_l3.png)
- Вступает в химические реакции с кислотными оксидами и образует соли:
![Rendered by QuickLaTeX.com \[ Ba\left ( OH \right )_2 + CO_2=BaCO_3 \downarrow +H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bebc0b5d566463b520e045770495c323_l3.png)
Получение
Гидроксид бария можно получить при взаимодействии бария с водой. Реакция идет уже при комнатной температуре:
![]()
Другой способ получения основывается на химической реакции оксида бария с водой:
![]()
Применение
Гидроксид бария используется в качестве реактива на сульфаты и карбонаты, для очищения растительных масел и животных жиров, как компонент различных смазок, и в неорганическом синтезе.
Примеры решения задач
| Задание | Рассчитайте |
| Решение | Запишем уравнение электролитической диссоциации Из уравнения диссоциации видно, что : Рассчитаем |
| Ответ |
| Задание | Найдите массовую долю гидроксида бария в растворе, который создает осмотическое давление в 1 атм при |
| Решение | Гидроксид бария — сильный электролит, который диссоциирует нацело с образованием трех частиц:
Запишем выражение для расчета осмотического давления для сильного электролита: где Пересчитаем молярную концентрацию в массовую долю, приняв плотность раствора за единицу, так как концентрация мала: Подставим численные значения: |
| Ответ | |











