Формула гидроксида фосфора
Определение и формула гидроксида фосфора
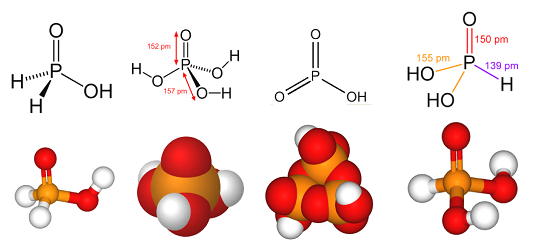
Существует несколько кислот, в которых фосфор проявляет различные степени окисления.
Фосфорноватистая кислота
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Сильный восстановитель, и соответственно слабый окислитель.
Физические свойства – белое или бесцветное кристаллическое вещество.
Хорошо растворяется в воде.
Химические свойства
- Как типичная кислота реагирует с щелочами с образованием солей:
![Rendered by QuickLaTeX.com \[ H(PH_2O_2) + NaOH = Na(PH_2O_2) + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-277af149ab48ee8ce54adffc8b0fc6e7_l3.png)
- Вступает в окислительно-восстановительное взаимодействие с оксидом мышьяка:
![Rendered by QuickLaTeX.com \[ 3H(PH_2O_2) + As_2O_3 = 2As + 3H_2(PHO_3) \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9b5edff49e1c98a14ec99df44e7c57e4_l3.png)
- При нагревании распадается на ортофосфорную кислоту и фосфин:
![Rendered by QuickLaTeX.com \[ 2H(PH_2O_2) = H_3PO_4 + PH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-03e2d578471f5026f8dd6f0c6cbebd84_l3.png)
Получение
Данную кислоту можно получить при взаимодействии фосфина с водой и иодом:
![]()
Фосфористая кислота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белые или бесцветные кристаллы.
Разлагается при нагревании.
Очень хорошо растворяется в воде.
Химические свойства
- При температуре
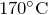 разлагается на ортофосфорную кислоту и фосфин:
разлагается на ортофосфорную кислоту и фосфин:
![Rendered by QuickLaTeX.com \[ 4H_2(PHO_3) = 3H_3PO_4 + PH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f3aa940324de8ec2a1eed3e19b9bc135_l3.png)
- Вступает в реакции окисления-восстановления:
![Rendered by QuickLaTeX.com \[ H_2(PHO_3) + 2AgNO_3 + H_2O = 2Ag \downarrow + H_3PO_4 + 2HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-208111bb05091bca709f4f24cbe93c18_l3.png)
- Вступает в реакции обмена с гидроксидом натрия:
![Rendered by QuickLaTeX.com \[ H_2(PHO_3) + 2NaOH = Na_2(PHO_3) + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b514de5a038eaba518713a11908d9375_l3.png)
Получение
Один из способов получения фосфористой кислоты основан на взаимодействии фосфина с концентрированной серной кислотой:
![]()
Метафосфорная кислота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – аморфное (стекловидное) вещество белого цвета, гигроскопичная.
Сублимируется при сильном нагревании.
Слабая одноосновная кислота.
Хорошо растворяется в воде.
Химические свойства
- Метафосфорная кислота растворяется в воде с образованием ортофосфорной кислоты:
![Rendered by QuickLaTeX.com \[ HPO_3 + H_2O = H_3PO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f6279f42a471a7369bc5e14a9aec88c7_l3.png)
- Взаимодействует с
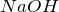 с образованием солей различного состава в зависимости от условий:
с образованием солей различного состава в зависимости от условий:
![Rendered by QuickLaTeX.com \[ HPO_3 + NaOH = NaPO_3 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b9d7466ea5c2257fd550a488d98a446a_l3.png)
Ортофосфорная кислота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветное гигроскопичное кристаллическое вещество.
Кислота средней силы.
Хорошо растворяется в воде.
Химические свойства
- Реагирует с щелочами, проявляя кислотные свойства:
![Rendered by QuickLaTeX.com \[ H_3PO_4 + 3KOH = K_3PO_4 + 3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f8e354e8a8891ef9a15ebbf7858e7aef_l3.png)
- При взаимодействии с металлом он вытесняет водород из фосфорной кислоты:
![Rendered by QuickLaTeX.com \[ 2H_3PO_4 + 3Mg = Mg_3(PO_4)_2 \downarrow + 3H_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b910432b2e75ed6da0744798eb882d72_l3.png)
- Вступает в реакции обмена с солями:
![Rendered by QuickLaTeX.com \[ H_3PO_4 + 3AgNO_3 = Ag_3PO_4 \downarrow + 3HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-26d7754d031e0211013b1e130a41b27e_l3.png)
Получение
Один из способов получения фосфорной кислоты основан взаимодействии пентахлорида фосфора с водой:
![]()
Примеры решения задач
| Задание | Найти массу ортофосфорной кислоты, которая может быть получена из |
| Решение | Запишем уравнения химических реакций, сопровождающих процесс:
Весь фосфор, входящий в состав апатита, идет на образование ортофосфорной кислоты. Согласно уравнениям химических реакций, из 1 моль Вычислим массу фосфата кальция, содержащегося в 1 кг апатита: тогда, Определим количество вещества фосфата кальция: Определим массу фосфорной кислоты: |
| Ответ |
| Задание | Сколько килограммов |
| Решение | Определим массу чистого фосфора:
Из одного моль или Найдем массу фосфорной кислоты: Определим массу раствора фосфорной кислоты: |
| Ответ | |











