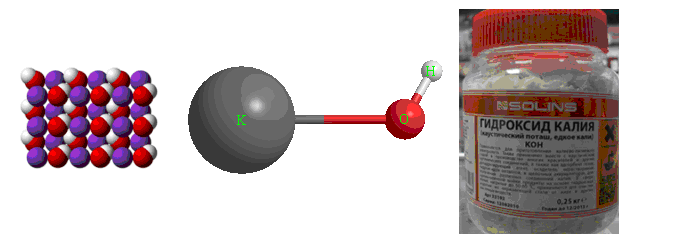
Формула гидроксида калия
Определение и формула гидроксида калия
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – твердое вещество белого цвета, весьма гигроскопичный.
Плавится и кипит без разложения.
Хорошо растворяется в воде, с сильным экзотермическим эффектом, создает сильнощелочную среду.
Химические свойства гидроксида калия
- Гидроксид калия проявляет свойства основных гидроксидов (относится к щелочам), поэтому он реагирует с кислотами:
![Rendered by QuickLaTeX.com \[ 2KOH+HNO_3=KNO_3+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-78aa96c0c8a6a4fdf0254191f6a41d72_l3.png)
- Реагирует с оксидами неметаллов:
![Rendered by QuickLaTeX.com \[ 2KOH+CO_2=K_2CO_3+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d5216f63717f7b44b079f510c46b8bcc_l3.png)
- Гидроксид калия также реагирует с амфотерными соединениями с образованием комплексных солей:
![Rendered by QuickLaTeX.com \[ KOH + Al\left ( OH \right )_3=K\left [ Al\left ( OH \right )_4 \right ] \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-96abb0b9776b817f36d753d616aef2b7_l3.png)
- Реагирует при сплавлении
 с оксидом алюминия:
с оксидом алюминия:
![Rendered by QuickLaTeX.com \[ 2KOH + Al_2O_3=2KAlO_2+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bf1d4d513215294e6968df808f0e6e65_l3.png)
- Реагирует с несолеобразующими оксидами азота:
![Rendered by QuickLaTeX.com \[ 2KOH+NO+NO_2=2KNO_2+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9bb3f146d569a851d8468aacc866f00b_l3.png)
Получение
Гидроксид калия можно получить непосредственно из самого калия:
![]()
![]()
При взаимодействии карбоната калия с гидроксидом кальция:
![]()
Применение
Применяется в пищевой промышленности в качестве пищевой добавки ![]() .
.
Используется в химическом синтезе.
Находит применение в качестве электролита в щелочных батарейках.
Примеры решения задач
| Задание | Определите массовую долю гидроксида в растворе, который имеет осмотическое давление 1 атм при |
| Решение | Гидроксид калия — сильный электролит и диссоциирует нацело с образованием двух частиц:
Запишем выражение для определения осмотического давления для сильного электролита: где Пересчитаем молярную концентрацию в массовую долю, приняв плотность раствора за единицу, так как концентрация мала: Подставим численные значения: |
| Ответ | |
| Задание | Вычислите |
| Решение | Запишем уравнение электролитической диссоциации Из уравнения диссоциации следует, что : Рассчитаем |
| Ответ |











