Формула гидроксида хлора
Определение и формула гидроксида хлора
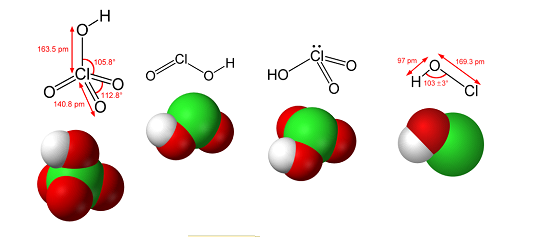
Существует несколько кислот, в которых хлор проявляет различные степени окисления.
Хлорноватистая кислота
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Степень окисления хлора равна +1.
Обладает слабыми кислотными свойствами.
Физические свойства – в свободном виде не выделена, но существует в растворе зеленовато-желтого цвета.
Перегоняется в вакууме, разлагается на свету. Экстрагируется из воды в эфир.
Образует соли — гипохлориты.
Химические свойства
- Вступает в реакцию с соляной кислотой с образованием хлора и воды:
![Rendered by QuickLaTeX.com \[ HClO + HCl = Cl_2 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-24bcf82488fd0af6dcf0900cbf8b2023_l3.png)
- Реагирует разбавленным раствором гидроксида натрия с образованием соли:
![Rendered by QuickLaTeX.com \[ HClO + NaOH = NaClO + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2e014121909742bfae7cfea30c51cc43_l3.png)
- В реакции с иодоводородом проявляет окислительные свойства:
![Rendered by QuickLaTeX.com \[ HClO + 2HI = HCl + I_2 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bfe9e2d1dbe24838c55fc195e0a30398_l3.png)
- Взаимодействует с сульфидом марганца:
![Rendered by QuickLaTeX.com \[ 4HClO + MnS = MnSO_4 + 4HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7b5d7e965033b6bb33ce69e17cb22518_l3.png)
Получение
Хлорноватистая кислота образуется из соответствующего оксида:
![]()
Хлористая кислота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – в свободном виде не выделена.
Существует в разбавленном растворе (бесцветный).
Очень неустойчивая.
Образует соли — хлориты.
Химические свойства
- При температуре
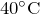 разлагается на оксид хлора (IV), соляную кислоту и воду:
разлагается на оксид хлора (IV), соляную кислоту и воду:
![Rendered by QuickLaTeX.com \[ 5HClO_2 = 4ClO_2 + HCl + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e340116498933480e8538c9857b3868c_l3.png)
- Реагирует с соляной кислотой:
![Rendered by QuickLaTeX.com \[ HClO_2 + 3HCl = 2Cl_2 \uparrow + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e0e3b89a5d36cbc43090682fd33e96c1_l3.png)
- Вступает в реакции обмена с гидроксидом натрия:
![Rendered by QuickLaTeX.com \[ HClO_2 + NaOH = NaClO_2 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-084df1e4186edaf01a57c972a47ae359_l3.png)
- Взаимодействует с хлорноватистой кислотой:
![Rendered by QuickLaTeX.com \[ HClO_2 + HClO = HCl + HClO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4557ee742654a14f9d07696433b0d9ff_l3.png)
Получение
Один из способов получения хлористой кислоты основан на взаимодействии оксида хлора (IV) с пероксидом водорода:
![]()
Хлорноватая кислота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – в свободном виде не выделена.
Существует в бесцветном растворе.
Сильная одноосновная кислота.
Образует соли — хлораты.
Химические свойства
- Реагирует с соляной кислотой:
![Rendered by QuickLaTeX.com \[ HClO_3 + 5HCl = 3Cl_2 \uparrow + 3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-075691555d83e428017dfde9c8c21ca3_l3.png)
- Взаимодействует с
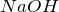 с образованием хлората натрия:
с образованием хлората натрия:
![Rendered by QuickLaTeX.com \[ HClO_3 + NaOH = NaClO_3 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3d41f8fe4df718b703ec115acef50d13_l3.png)
- Вступает в реакции окисления-восстановления:
![Rendered by QuickLaTeX.com \[ HClO_3 + 3H_2SO_4 + 6FeSO_4 = 3Fe_2(SO_4)_3 + HCl + 3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5947c6d34a3fa40304d7dda2e796f192_l3.png)
Получение
Один из способов получения хлорноватой кислоы основан на взаимодействии хлората бария и серной кислоты:
![]()
Хлорная кислота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветная гигроскопичная легкоподвижная жидкость.
Неограниченно смешивается с водой.
Концентрированные растворы маслообразны.
Сильная кислота.
Образует соли — перхлораты.
Химические свойства
- Реагирует с щелочами, проявляя кислотные свойства:
![Rendered by QuickLaTeX.com \[ HClO_4 + NaOH = NaClO_4 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1c631a755499afd7027eb9fd4b7f263b_l3.png)
- Реагирует с хлоридом калия с образованием перхлората калия:
![Rendered by QuickLaTeX.com \[ HClO_4 + KCl = KClO_4 \downarrow + HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-40032fab80247a67bf398282aca37ae1_l3.png)
- Безводная хлорная кислота реагирует с графитом:
![Rendered by QuickLaTeX.com \[ 4HClO_4 + 7C = 7CO_2 + 2Cl_2 + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8ceb690090343dafe242006106ab74aa_l3.png)
Получение
Один из способов получения хлорной кислоты основан на диспропорционировании кипящего раствора хлорноватой кислоты:
![]()
Примеры решения задач
| Задание | Каков pH 0,01 М раствора хлорноватистой кислоты? |
| Решение | Хлорноватистая кислота является слабой и ее константа диссоциации равна:
Запишем выражение для электролитической диссоциации кислоты: При достижении равновесия где Запишем выражение для Так как Определим |
| Ответ |
| Задание | К 20 граммам 10%-ного раствора хлорида хлорной кислоты прилили 20 грамм 10%-ного раствора гидроксида калия. Какое из реагирующих веществ находится в недостатке? |
| Решение | Запишем уравнение взаимодействия хлорной кислоты и гидроксида калия:
Исходя из уравнения определим количество моль хлорной кислоты: Найдем количество моль гидроксида калия: Таким образом, хлорная кислота находится в недостатке. |
| Ответ | Хлорная кислота. |











