Формула гидроксида кальция
Определение и формула гидроксида кальция
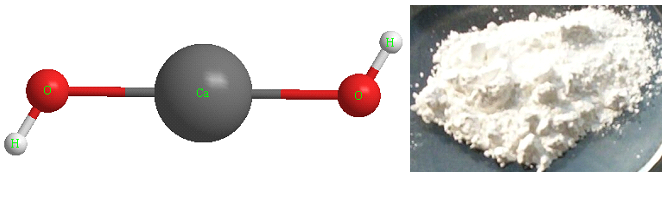
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белая порошкообразная субстанция, плохо растворимая в воде.
Химические свойства гидроксида кальция
- Гидроксид кальция при нагревании (
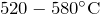 ) разлагается без плавления:
) разлагается без плавления:
![Rendered by QuickLaTeX.com \[ Ca\left ( OH \right )_2=CaO+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2a53810b451aa2b0ab147e998042b498_l3.png)
- Проявляет основные свойства, реагируя с кислотами:
![Rendered by QuickLaTeX.com \[ Ca\left ( OH \right )_2 + 2HCl=CaCl_2+2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7cbdd7b13bc37bf6e3a578b7f052d1af_l3.png)
![Rendered by QuickLaTeX.com \[ Ca\left ( OH \right )_2 + H_2SO_4=CaSO_4 \downarrow +2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-879b8b8ccd153b866a77281abc01dd4d_l3.png)
- Вступает в химическое взаимодействие с кислотными оксидами с образованием солей:
![Rendered by QuickLaTeX.com \[ Ca\left ( OH \right )_2 + CO_2=CaCO_3 \downarrow +H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0e0fa1aeeda321022a291c60e15662fe_l3.png)
Получение
Гидроксид кальция можно получить при взаимодействии кальция с водой. Реакция идет уже при комнатной температуре:
![]()
Другой способ получения основывается на химической реакции оксида кальция с водой:
![]()
Применение гидроксида кальция
Гашеная известь находит широкое применение. Она используется при побелке помещений, заборов. Издавна применяется в строительстве. Ее используют для умягчения воды. Гидроксид кальция является исходным реагентов для получения хлорной извести, удобрений. В пищевой промышленности зарегистрирован в качестве пищевой добавки E526. Это далеко не все способы применения данного соединения.
Примеры решения задач
| Задание | Какова массовая доля |
| Решение | Молярную растворимость Тогда, равновесная концентрация ионов а равновесная концентрация гидроксид-анионов Запишем выражение для определения произведения растворимости Из справочника найдем, что : Выразим из данного выражения
Так как из 1 моль гидроксида кальция образуется 1 моль ионов
Пересчитаем молярность в массовую долю, приняв плотность раствора за единицу, так как концентрация раствора мала:
|
| Ответ |
| Задание | Вычислите |
| Решение | Концентрацию гидроксид анионов рассчитаем через произведение растворимости как и в первом примере:
Из справочника найдем, что : Выразим из данного выражения
Определим равновесную концентрацию
Рассчитаем |
| Ответ |











