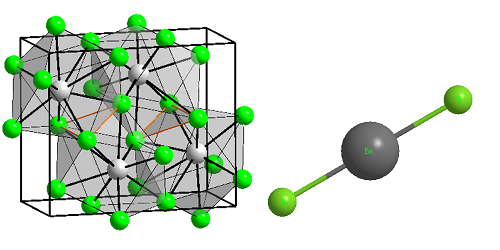
Формула хлорида бария
Определение и формула хлорида бария
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белые кристаллы, плавящиеся без разложения; хорошо растворяется в воде, не гидролизуется.
Токсичен, гигроскопичен, дает желто-зеленое окрашивание пламени.
Химические свойства хлорида бария
- Хорошо растворяется в концентрированной азотной кислоте. Не растворяется в концентрированной соляной кислоте. Разлагается концентрированной серной кислотой:
![Rendered by QuickLaTeX.com \[ BaCl_2+H_2SO_4=BaSO_4 \downarrow +2HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-772b68be6bcdfa59fac566f9b0ae8978_l3.png)
- Взаимодействует с парами воды при
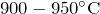 с образованием оксида бария и хлороводорода:
с образованием оксида бария и хлороводорода:
![Rendered by QuickLaTeX.com \[ BaCl_2+H_2O=BaO+2HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a120e30586be038814da4be405289c5b_l3.png)
- Вступает в реакции обмена с солями, обязательно должен образовываться осадок:
![Rendered by QuickLaTeX.com \[ BaCl_2+Na_2CO_3=BaCO_3 \downarrow +2NaCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4d68540fdac2f86186202b12a3481d7f_l3.png)
Получение
Хлорид бария можно получать разными способами. Например, химической реакцией между металлическим барием и хлором:
![]()
По реакции нейтрализации между гидроксидом бария и соляной кислотой:
![]()
При взаимодействии карбоната бария с соляной кислотой:
![]()
Применение
Поскольку хлорид бария достаточно дешевая растворимая соль бария, то он находит широкое применение в лабораторных нуждах. Он широко используется для обнаружения сульфат-иона. В промышленности хлорид бария используется, главным образом, в производстве пигментов, для закалки быстрорежущей стали, в качестве компонента керамики.
Примеры решения задач
| Задание | Рассчитайте сколько грамм бариевой соли может получиться из |
| Решение | Запишем уравнение химической реакции:
Рассчитаем количество моль Из уравнения реакции следует, что Вычислим массу сульфата бария |
| Ответ |
| Задание | Сколько граммов хлорида бария |
| Решение | Запишем уравнение химического взаимодействия:
Вычислим количество моль исходных веществ: Из уравнения реакции следует, что Таким образом, Из Определим массу хлорида бария: Запишем выражение для определения практического выхода Выразим и определим практическую массу хлорида бария: |
| Ответ |











