Формула уксусной кислоты
Химическая и структурная формулы уксусной кислоты
Химическая формула: CH3COOH
Брутто-формула: C2H4O2
Структурная формула:
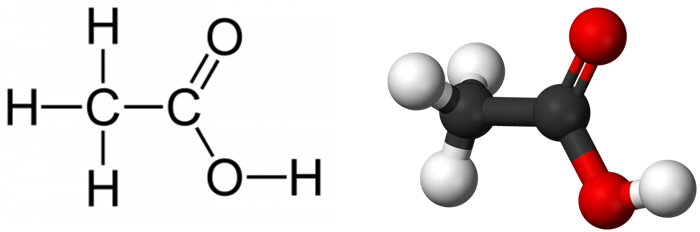
Молярная масса: 60,05 г/моль.
Уксусная кислота – предельная одноосновная карбоновая кислота. Образует соли – ацетаты.
Слабая кислота, константа диссоциации Ka=1,75 •10–5, рКа = 4,76.
Физические свойства уксусной кислоты
Уксусная кислота — бесцветная жидкость с резким характерным запахом, кислым вкусом. Гигроскопична, неограниченно растворяется в воде. Существует в виде димеров. Безводная уксусная кислота называется ледяной, поскольку при замерзании образует льдовидную массу.
Химические свойства уксусной кислоты
Уксусная кислота проявляет все основные свойствами карбоновых кислот.
- Взаимодействует с активными металлами с образованием водорода и соответствующих солей (ацетатов):
![Rendered by QuickLaTeX.com \[ Mg + 2CH_{3}COOH = (CH_{3}COO)_{2}Mg + H_{2} \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-06e4535557c5aab4c41bb3b85043c738_l3.png)
- Взаимодействует с оксидами металлов:
![Rendered by QuickLaTeX.com \[ CaO + 2CH_{3}COOH = (CH_{3}COO)_{2}Ca + H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-eb9a9f470482e2930304f414981647b5_l3.png)
- Взаимодействует с гидроксидами металлов:
![Rendered by QuickLaTeX.com \[ NaOH + CH_{3}COOH \to CH_{3}COONa + H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-74bbffee8a4b8fd9ac4632dd8a07d9ff_l3.png)
- В присутствии серной кислоты вступает в реакцию этерификации с образованием сложных эфиров:
![Rendered by QuickLaTeX.com \[ CH_{3}COOH + С_{2}H_{5}ОН \to CH_{3}COOC_{2}H_{5} + 2H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b5ab63de3a128659dfb5426a107d9a96_l3.png)
- Вступает в реакции галогенирования с образованием галогенуксусных кислот:
![Rendered by QuickLaTeX.com \[ CH_{3}COOH + Cl_{2} \to CH_{2}ClCOOH + HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-390cd49cf0afc099e94ea63fe638b80d_l3.png)
- Реакция горения:
![Rendered by QuickLaTeX.com \[ CH_{3}COOH + O_{2} \to CO_{2} + 2H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0ed4f2a61707825c6bae90d5d956322d_l3.png)
Качественной реакцией на соли уксусной кислоты является взаимодействие с сильными кислотами. Уксусная кислота слабая и вытесняется сильными кислотами из растворов солей, при этом появляется ее характерный запах:
![]()
Получение. Наиболее экономически выгодный промышленный способ получения уксусной кислоты – карбонилирование метанола моноксидом углерода, катализатор – соли родия, промотор – иодид-ионы:
![]()
Биохимический способ – окисление этанола:
![]()
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260), бытовой кулинарии, и консервировании. Уксусную кислоту применяют для получения лекарственных и душистых веществ, в качестве растворителя.

|
Концентрированная уксусная кислота (с концентрацией более 30%) способна вызывать химические ожоги. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей |
Примеры решения задач
| Задание | Вычислите рН раствора уксусной кислоты с молярной концентрацией 1 моль/л, константа диссоциации которой равна 1,75 • 10–5. |
| Решение | Запишем уравнение диссоциации уксусной кислоты:
Константа диссоциации кислоты: Обозначим за х концентрацию ионов водорода х = [H+], тогда выражение для константы диссоциации примет вид: Отсюда Поскольку уксусная кислота – слабая, то x << C, то полученное выражение можно упростить:
pH – отрицательный десятичный логарифм равновесной концентрации ионов водорода Н+. Поскольку х = [H+], то |
| Ответ | рН раствора равен 2,38 |
| Задание | Вычислить pH раствора, полученного при добавлении к 10 мл 0,1 М раствора уксусной кислоты 5 мл 0,1 М раствора гидроксида натрия. Константа диссоциации уксусной кислоты Kа = 1,75 •10–5. |
| Решение | Суммарный объем раствора будет равен:
При сливании растворов протекает реакция: Рассчитаем количества вещества уксусной кислоты и гидроксида натрия:
По уравнению реакции n(CH3COOH) = n(NaOH), а в нашем случае n(CH3COOH) > n(NaOH), следовательно, уксусная кислота взята в избытке. После протекания реакции в растворе будут находиться уксусная кислота и ацетат натрия, т.е. мы получили буферную систему. Рассчитаем концентрацию ацетата натрия в полученном растворе:
Концентрация уксусной кислоты в растворе будет равна:
Концентрация ионов водорода в буферном растворе рассчитывается по формуле: 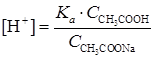
где Ka – константа диссоциации уксусной кислоты. Тогда:
Рассчитаем рН раствора: |
| Ответ | рН полученного раствора равен 4,76. |











