Формула фенола
Структурная и химическая формула фенола
Химическая формула: C6H5OH
Брутто-формула: C6H6O
Структурная формула:
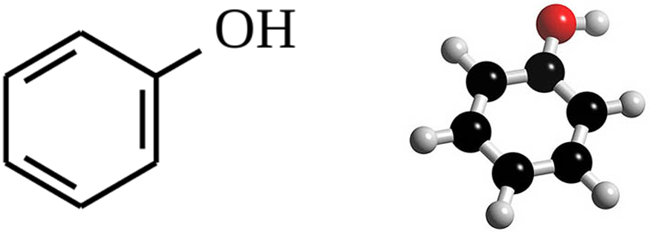
Молярная масса: 94,11г/моль
Фенол является простейшим представителем класса фенолов – ароматических спиртов.
Физические свойства. При обычных условиях – бесцветные кристаллы с характерным сладковато-приторным запахом (запах гуаши), розовеют на воздухе из-за окислительных процессов. Температура плавления +40,9°С.
Хорошо растворим в органических растворителях (этаноле, диэтиловом эфире, ацетоне, CHCl3 и др.), умеренно растворим в воде (6,7 г на 100 мл при 16°C, выше 66°C растворяется в воде неограниченно).
Химические свойства
Фенол является слабой кислотой, рКа = 9,98. Кислотные свойства выражены сильнее, чем у спиртов.
- Взаимодействует со щелочами и металлическим натрием с образованием соответствующих солей – фенолятов, с общей формулой C6H5OMe:
![Rendered by QuickLaTeX.com \[ C_{6}H_{5}OH + NaOH \to C_{6}H_{5}ONa + H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f47515d1528048564361a78f6d4a9a30_l3.png)
![Rendered by QuickLaTeX.com \[ 2C_{6}H_{5}OH + 2Na \to 2C_{6}H_{5}ONa + H_{2} \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d4df213a85198473a68d5a359077bfc2_l3.png)
- Легко вступает в реакции электрофильного замещения (алкилирования, ацилирования, галогенирования, нитрования и сульфирования), которые протекают в орто- и пара- положения:
![Rendered by QuickLaTeX.com \[ C_{6}H_{5}OH + 3HNO_{3} \to C_{6}H_{2}(NO_{2})_{3}OH + 3H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d5095642f5a559afc6d2df70de95429a_l3.png)
с образованием 2,4,6-тринитрофенола.
Качественные реакции на фенол.
- Реакция с бромной водой – образуется белый осадок 2,4,6-трибромфенола:
![Rendered by QuickLaTeX.com \[ C_{6}H_{5}OH + 3Br_{2} \to C_{6}H_{2}Br_{3}OH + 3HBr \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-26aab5ce4f6ad3cd87ac01843dde8c2c_l3.png)
- Реакция с хлоридом железа (III) с образованием фенолята железа фиолетового цвета:
![Rendered by QuickLaTeX.com \[ 6C_{6}H_{5}OH + FeCl_{3} \to [Fe(C_{6}H_{5}OH)_{6}]Cl_{3} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7b2b1ad22d9ee63b6550284acf3bba3b_l3.png)

|
Фенол – ядовитое вещество. Относится к высокоопасным веществам. Вдыхание паров фенола может привести к раздражению носоглотки, ожогам дыхательных путей и отеку легких с летальным исходом. При попадании раствора фенола на кожу образуются химические ожоги. |
Примеры решения задач по теме «фенол формула»
| Задание | Какую массу фенола следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7°С? Криоскопическая константа бензола равна 5,1°С. |
| Решение | По закону Рауля понижение температуры кристаллизации разбавленных растворов неэлектролитов равно:
где Сm – моляльная концентрация раствора, К – криоскопическая константа растворителя. Рассчитаем моляльную концентрацию фенола:
Моляльная концентрация раствора фенола равна: 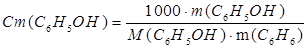
Молярная масса фенола C6H5OH равна 94г/моль. Выразим массу фенола:
|
| Ответ | Нужно растворить 3,88г фенола. |
| Задание | При взаимодействии смеси этилового спирта и фенола с избытком натрия выделилось 6,72 л водорода (н.у.). Для полной нейтрализации этой же смеси потребовалось 25 мл 40%-ного раствора гидроксида калия с плотностью 1,4 г/мл. Определите процентный состав исходной смеси. |
| Решение | Запишем уравнения реакций.
С натрием реагируют оба вещества: а с гидроксидом калия – только фенол: Масса раствора гидроксида калия равна:
Масса гидроксида калия равна:
Рассчитаем количество вещества гидроксида калия:
По уравнению реакции:
Количество вещества выделившегося водорода равно:
Количество водорода, выделившегося при реакции фенола с натрием равно:
Количество водорода, выделившегося при реакции этанола с натрием равно:
Количество вещества этанола равно:
Рассчитаем массы веществ в исходной смеси:
Массовые доли веществ в смеси будут равны: 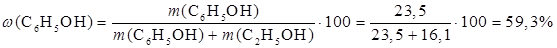
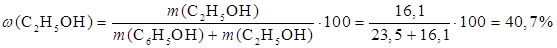
|
| Ответ | Смесь содержит 59,3 % фенола, 40,7% этанола. |











