Формула щавелевой кислоты
Определение и формула щавелевой кислоты
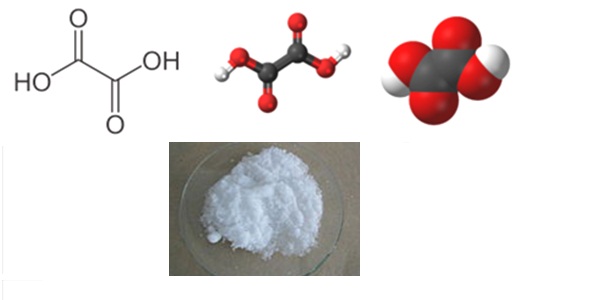
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветное кристаллическое твердое вещество, которое образует бесцветный водный раствор.
Это простейшая органическая дикарбоновая кислота.
Она значительно сильнее по сравнению с уксусной кислотой.
Щавелевую кислоту применяют в качестве восстанавливающего агента, и ее сопряженное основание называют оксалатом ![]() – хелатирующий агент для катионов металлов.
– хелатирующий агент для катионов металлов.
Обычно, щавелевая кислота образует дигидрат с формулой ![]() .
.
Взаимодействие данной кислоты с кожей, может представлять опасность.
Химические свойства щавелевой кислоты
- Щавелевая кислота достаточно сильная, несмотря на то что она является карбоновой кислотой:
![Rendered by QuickLaTeX.com \[ C_2O_4H_2 \rightleftharpoons C_2O_4H^- + H^+ ; pK_a = 1,27 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1278137cc2f7b71ecbf94ae1fab9a8d1_l3.png)
![Rendered by QuickLaTeX.com \[ C_2O_4H^- \rightleftharpoons C_2O_4^{2-} + H^+ ; pK_a = 4,27 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5ecc414489ec5f8e416772bf0a641c9c_l3.png)
- Щавелевая кислота вступает во многие реакции, характерные для карбоновых кислот. Она образует эфиры, такие как диметилоксалат. Из нее получается оксалилхлорид.
- Важной в аналитической химии является реакция окисления щавелевой кислоты перманганатом калия в кислой среде, которая протекает как автокаталитическая реакция:
![Rendered by QuickLaTeX.com \[ 5H_2C_2O_4 + 2KMnO_4 + 3H_2SO_4 = 2MnSO_4 + K_2SO_4 + 10CO_2 + 8H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-105ec7352511df229ef93471b278e674_l3.png)
Применение
В лабораторных условиях щавелевую кислоту иногда применяют для получения ![]() и
и ![]() .
.
Помимо этого, щавелевая кислота используется для лабораторного синтеза диоксида хлора:
![]()
Применяется в текстильной и кожевенной промышленности в качестве протравы.
Они служат компонентами анодных ванн для осаждения металлических покрытий — алюминия, титана и олова.
Щавелевая кислота и ее соли имеют чрезвычайно важное значение как в органической так и в аналитической химии.
Примеры решения задач
| Задание | Рассчитайте массу щавелевой кислоты в растворе, если на его титрование пошло |
| Решение | Запишем химическую реакцию:
Вычислим число моль Из стехиометрических соотношений следует, что Рассчитаем массу |
| Ответ | |
| Задание | Имеется 1 литр раствора щавелевой кислоты. Какую минимальную массу ионов бария |
| Решение | Для решения данной задачи найдем концентрацию оксалат-ионов Пусть Так как В итоге имеем: Данное решение справедливо при условии Запишем условие гетерогенного равновесия: PR = PR — произведение растворимости (данные взяты из справочника Лурье Ю.Ю. «Справочник по аналитической химии», стр. 70). Рассчитаем молярную концентрацию Определяем массу ионов бария |
| Ответ |











