Формула алканов
Общая формула алканов: CnH2n+2 (n ![]() 1)
1)
Молекулярные и структурные формулы алканов
Первые представители гомологического ряда алканов:
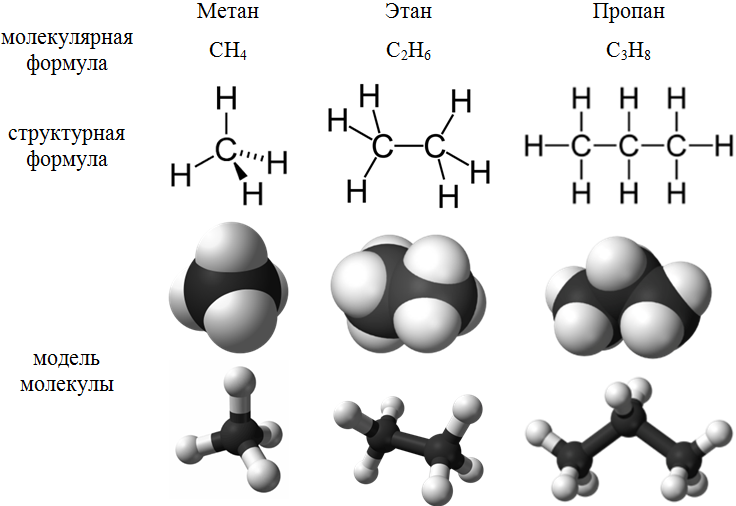
Алканы называются насыщенными углеводородами, поскольку содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp![]() -гибридизации – 4 гибридные орбитали атома углерода равнозначны по форме и энергии и направлены к вершинам тетраэдра:
-гибридизации – 4 гибридные орбитали атома углерода равнозначны по форме и энергии и направлены к вершинам тетраэдра:
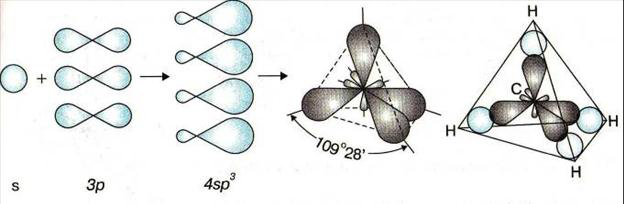
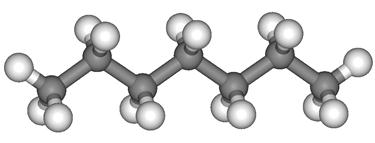
Тетраэдрическое расположение гибридных орбиталей одинаково для всех атомов углерода в алканах, поэтому молекулы алканов имеют зигзагообразное строение:
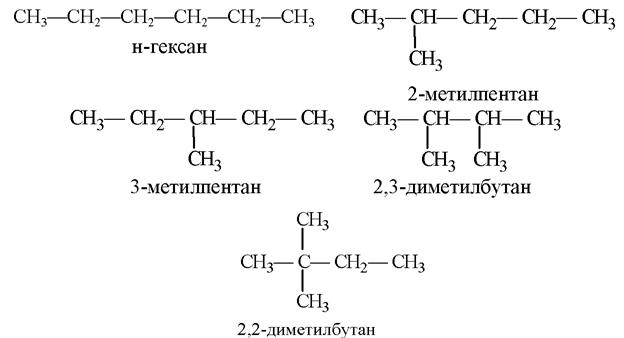
При n > 3 у алканов возможна изомерия углеродного скелета:
а при n > 6 – оптическая изомерия.
Алканы химически малоактивны, поскольку одинарные связи C–H и C–C довольно прочные. Все связи в молекулах алканов являются ![]() -связями, малополярны и слабо поляризуются, поэтому алканы, в основном, вступают в реакции по радикальному механизму (радикальное галогенирование, сульфохлорирование, нитрование, автоокисление).
-связями, малополярны и слабо поляризуются, поэтому алканы, в основном, вступают в реакции по радикальному механизму (радикальное галогенирование, сульфохлорирование, нитрование, автоокисление).
Основным практически значимым химическим свойством алканов является реакция горения:
![]()
Из-за большого теплового эффекта таких реакций алканы используются в качестве топлива.
Примеры решения задач по теме «формула алканов»
| Задание | Массовая доля углерода в алкане составляет 83,72%. Определите его молекулярную формулу. |
| Решение | Общая формула алканов CnH2n+2
Масса 1 моля алкана равна: Масса углерода в алкане равна: Массовая доля углерода в алкане равна: Следовательно, молекулярная формула алкана C6H14. |
| Ответ | Молекулярная формула алкана C6H14 |
| Задание | Газ, который образовался при полном сгорании 0,1 моль неизвестного алкана, пропустили через избыток известковой воды, при этом выпал осадок массой 60 г. Определите молекулярную формулу и строение данного алкана, если известно, что в его составе есть один четвертичный атом углерода. |
| Решение | Запишем уравнение реакции горения алкана:
Из уравнения реакции следует, что при сгорании 1 моля алкана, образуется n моль СО2. При пропускании углекислого газа через известковую воду выпадает осадок карбоната кальция: Количество вещества карбоната кальция равно:
По уравнению реакции
Поскольку при сгорании 0,1 моль алкана выделилось 0,6 моль СО2, то Следовательно, молекулярная формула алкана – С6Н14 Среди алканов, имеющих формулу С6Н14, четвертичный атом углерода имеет 2,2-диметилбутан: 
|
| Ответ | С6Н14 — 2,2-диметилбутан. |











