Формула карбоновой кислоты
Карбоксильная группа состоит из карбонильной группы > C=O и связанной с ней гидроксильной группы –ОН.
Общая формула карбоновых кислот
Общая формула карбоновых кислот: R–COOH.
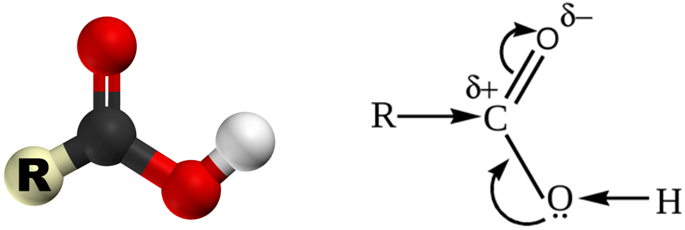
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду, что обусловливает возникновение частичного положительного заряда на атоме водорода.
В результате полярность связи О–Н возрастает, и становится возможным процесс диссоциации:
![]()
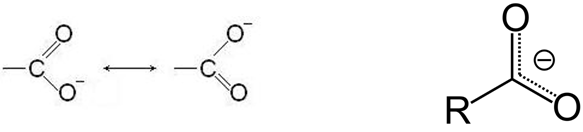
Образующийся анион стабилизируется за счет делокализации заряда:
Низшие карбоновые кислоты, содержащие до 3 атомов углерода – бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот, содержащих 4–9 атомов углерода – маслянистые жидкости с неприятным запахом. Кислоты, содержащие больше 10 атомов водорода – твёрдые вещества, нерастворимые в воде.
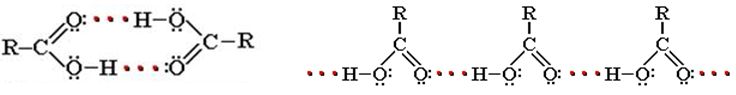
Растворимость карбоновых кислот в воде и высокие температуры кипения связаны с образованием межмолекулярных водородных связей. В твердом состоянии карбоновые кислоты существуют главным образом в виде циклических димеров, а в жидком происходит и линейная ассоциация:
Виды карбоновых кислот
В зависимости от строения углеводородного радикала, карбоновые кислоты разделяются на:
- ароматические (бензойная кислота)
- алифатические (предельные (капроновая кислота) и непредельные (акриловая кислота))
- алициклические (хинная кислота)
- гетероциклические (никотиновая кислота).
По числу карбоксильных групп карбоновые кислоты разделяются на:
- одноосновные (уксусная кислота)
- двухосновные (щавелевая кислота)
- многоосновные (лимонная кислота).
При введении в молекулу кислоты других функциональных групп (–ОН, =CO, –NH2 и др.) образуются другие классы соединений: окси-, кетокислоты, аминокислоты и др.
Общая формула предельных одноосновных карбоновых кислот:
С n H2nO2 (n = 1,2,3…) или C< sub>nH2n+1COOH (n = 0,1,2…)
Общая формула непредельных одноосновных карбоновых кислот:
С n H 2 n –2 O 2 (n = 1,2,3…) или CnH 2n–1 COOH (n = 0,1,2…)
Общая формула предельных двухосновных карбоновых кислот:
CnH2n–2O4 (n = 2,3…)
Названия и формулы некоторых карбоновых кислот
|
Формула карбоновой кислоты |
Название по ИЮПАК |
Тривиальное название |
|---|---|---|
|
Предельные одноосновные карбоновые кислоты |
||
|
HCOOH |
метановая |
муравьиная |
|
CH3COOH |
этановая |
уксусная |
|
C2H5COOH |
пропановая |
пропионовая |
|
C3H7COOH |
бутановая |
масляная |
|
C4H9COOH |
пентановая кислота |
валериановая кислота |
|
C5H11COOH |
гексановая кислота |
капроновая кислота |
|
C17H35COOH |
октадекановая |
стеариновая |
|
Непредельные одноосновные карбоновые кислоты |
||
|
CH2=CH–COOH |
2-пропеновая |
акриловая |
|
CH3–CH=CH–COOH |
2-бутеновая |
кротоновая |
|
CH2=CH–CH2–COOH |
3-бутеновая |
винилуксусная |
|
CH2=C(CH3)COOH |
2-метил-2-пропеновая |
метакриловая |
|
Двухосновные карбоновые кислоты |
||
|
COOH–COOH |
этандиовая |
щавелевая |
|
COOH–CH2–COOH |
пропандиовая |
малоновая |
|
COOH–(CH2)2–COOH |
бутандиовая |
янтарная |
|
COOH–(CH2)3–COOH |
пентандиовая |
глутаровая |
|
COOH–(CH2)4–COOH |
гександиовая |
адипиновая |
Примеры решения задач
| Задание | В трех одинаковых пробирках без подписей находятся три кислоты: муравьиная, уксусная и соляная. Как на основании различия их химических свойств определить, какая кислота находится в каждой пробирке? |
| Решение | Муравьиная кислота проявляет также некоторые свойства альдегидов (восстановительные). Поэтому ее можно определить
, например, по реакции с гидроксидом меди
(II), в случае муравьиной кислоты образуется оксид меди (I) красного цвета:
Различить оставшиеся кислоты можно по реакции с нитратом серебра. В случае соляной кислоты выпадает белый осадок хлорида серебра: Ацетат серебра растворяется в воде, поэтому в пробирке с уксусной кислотой изменений не произойдет. Таким образом, в оставшейся пробирке – уксусная кислота. |
| Задание | Определить формулу сложного эфира, если при гидролизе его образца массой 2,64 г выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты. |
| Решение | Общая формула сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода:
Таким образом, формула спирта: а формула кислоты: Запишем уравнение гидролиза сложного эфира: В соответствии с законом сохранения массы веществ, масса продуктов реакции равна массе исходных веществ. Рассчитаем массу воды:
Рассчитаем количество вещества воды:
По уравнению реакции n(кислоты) = n(спирта) Найдем молярные массы кислоты и спирта: М(кислоты) М(спирта) Найдём коэффициенты n и m из формул кислоты и спирта: Формула кислоты CH3COOH – уксусная кислота Формула спирта C2H5OH – этанол. Таким образом, формула сложного эфира CH3COOC2H5 – этиловый эфир уксусной кислоты, этилацетат. |
| Ответ | Формула сложного эфира CH3COOC2H5 |











