Формула карбоната кальция
Определение и формула карбоната кальция

Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белые кристаллы, находится в различных минералах (кальцит – тригональный, арагонит – ромбический).
Практически не растворяется в воде. Произведение растворимости ![]()
Является главной составной частью известняка, мрамора, мела.
Плавится без разложения под избыточным давлением углекислого газа.
Химические свойства карбоната кальция
- Не реагирует со щелочами. Разлагается кислотами:
![Rendered by QuickLaTeX.com \[ CaCO_3+2HCl=CaCl_2+CO_2 \uparrow +H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3802ccc9e3154f7109f4d1d213d1a38c_l3.png)
- Взаимодействует с хлоридом аммония при нагревании:
![Rendered by QuickLaTeX.com \[ CaCO_3+2NH_4Cl=CaCl_2+2NH_3+H_2O+CO_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-10630c84898fe34bc2567643e10186ff_l3.png)
- Переводится в раствор избытком
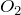 , образуется гидрокарбонат
, образуется гидрокарбонат 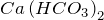 (известный только в растворе), который определяет временную жесткость природных вод:
(известный только в растворе), который определяет временную жесткость природных вод:
![Rendered by QuickLaTeX.com \[ CaCO_3+CO_2+H_2O=Ca\left ( HCO_3 \right )_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-886b4e34e83c6ed021bbd02395179594_l3.png)
- Вступает в реакцию с оксидом кремния:
![Rendered by QuickLaTeX.com \[ CaCO_3+SiO_2=CaSiO_3+CO_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6eaef094d61170cd364919bc6e48d82a_l3.png)
- При прокаливании
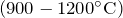 разлагается:
разлагается:
![Rendered by QuickLaTeX.com \[ CaCO_3=CaO+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3e534126e73cfd6a003d63a8091e4d1c_l3.png)
Получение
Карбонат кальция добывается их полезных ископаемых. Чистый ![]() , необходимый для пищевой или фармацевтической промышленности, можно получить из мрамора. Альтернативный способ получения основывается на процессе кальцинации
, необходимый для пищевой или фармацевтической промышленности, можно получить из мрамора. Альтернативный способ получения основывается на процессе кальцинации ![]() . При этом можно записать химические превращения сопровождающие его:
. При этом можно записать химические превращения сопровождающие его:
![]()
![]()
Применение
В пищевой промышленности карбонат кальция применяется в качестве белого пищевого красителя ![]() . Поскольку он входит в состав мела, то применяется для письма. Используется для побелки потолков, покраски стволов деревьев. Также данное вещество находит применение при производстве красок, резины, бытовой химии (зубной пасты), в строительстве (шпаклевки, герметики). Его используют как отбеливающее средство. Можно с уверенностью сказать, что одними из массовых потребителей карбоната кальция являются производители пластмассы, которые используют его в качестве наполнителя и красителя. Еще одна отрасль применения – его использование в очистительных системах.
. Поскольку он входит в состав мела, то применяется для письма. Используется для побелки потолков, покраски стволов деревьев. Также данное вещество находит применение при производстве красок, резины, бытовой химии (зубной пасты), в строительстве (шпаклевки, герметики). Его используют как отбеливающее средство. Можно с уверенностью сказать, что одними из массовых потребителей карбоната кальция являются производители пластмассы, которые используют его в качестве наполнителя и красителя. Еще одна отрасль применения – его использование в очистительных системах.
Примеры решения задач
| Задание | Чему равно произведение растворимости |
| Решение | Рассчитаем количество моль кальция
Найдем молярность ионов кальция в растворе:
Рассмотрим равновесие осадок-раствор:
Запишем выражение для расчета произведения растворимости карбоната кальция: Из расчета выше имеем:
Из равновесия видно, что |
| Ответ |
| Задание | Чему равна стандартная энтропия образования |
| Решение | Запишем выражение для стандартного изменения энтальпии реакции через стандартные энтальпии образования веществ:
Выразим стандартную энтальпию образования карбоната кальция: Величины стандартных энтальпий образования оксида кальция и углекислого газа возьмем из справочника.
Подставим численные значения:
|
| Ответ |











