Пространственное строение алканов
Общие сведения о пространственном строении алканов
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH2, а вещества, входящие в гомологический ряд, называются гомологами.
При обычных условиях С1-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле.
Пространственное строение алканов
Для полного описания молекулы необходимо знать не только её химическое строение, т.е. последовательность и тип связей между атомами в ней, но и расположение атомов в пространстве. В основе понимания пространственного строения алканов лежит представление о тетраэдрической конфигурации атомов углерода в состоянии sp3-гибридизации (рис. 1).
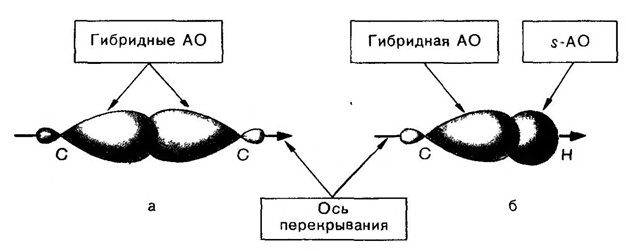
Рис. 1. Образование С-С и С-Н связей.
Рассмотрим пространственное строение алканов на примере молекулы метана (CH4). В молекуле метана четыре σ-связи sp3-гибридизованного атома углерода с атомами водорода направлены в пространстве под углом 109,5o. Этот угол называют нормальным валентным углом. Воображаемые линии, соединяющие атомы водорода, образуют правильный треугольник с атомом углерода в центре (рис. 2).
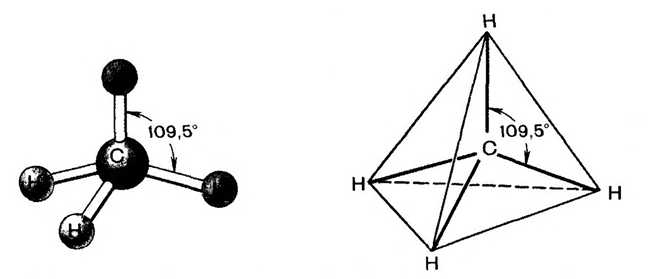
Рис. 2. Тетраэдрическая конфигурация sp3-гибридизованного атома углерода в метане.
Наглядное представление пространственного строения молекул алканов (и других органических веществ) можно получить при помощи шаростержневых или полусферических (Стюарта-Бриглеба) моделей.
Примеры решения задач
| Задание | Рассчитайте объемы хлора и метана, приведенные к нормальным условиям, которые потребуются для получения тетрахлорида углерода массой 38,5 г. |
| Решение | Запишем уравнение реакции хлорирования метана до тетрахлорида углерода (реакция происходит под действием УФ-излучения):
CH4 + 4Cl2 = CCl4 + 4HCl. Рассчитаем количество вещества тетрахлорида углерода (молярная масса равна – 154 г/моль): n = m / M; n(CCl4) = m (CCl4) / M (CCl4); n(CCl4) = 38,5 / 154 = 0,25 моль. Согласно уравнению реакции n(CCl4) : n(CH4) = 1:1, т.е. n(CCl4) = n(CH4) = 0,25 моль. Тогда объем метана будет равен: V = n × Vm; V(CH4) = n(CH4) × Vm; V(CH4) = 0,25 × 22,4 = 5,6 л. По уравнению реакции найдем количество вещества хлора. n(CCl4) : n(Cl2) = 1:4, т.е. n(Cl2) =4 × n(CCl4) = 4 × 0,25 = 1 моль. Тогда объем хлора будет равен: V = n × Vm; V(Cl2) = n(Cl2) × Vm; V(Cl2) = 1 × 22,4 = 22,4 л. |
| Ответ | Объемы хлора и метана равны 22,4 и 5,6 л соответственно. |
| Задание | Рассчитайте объем хлора, приведенный к нормальным условиям, который необходим для хлорирования 4,48 л метана (н.у.) до хлороформа. | |
| Решение | Запишем уравнение реакции хлорирования метана до хлороформа углерода (реакция происходит под действием УФ-излучения):
CH4 + 3Cl2 = CHCl3 + 3HCl. Рассчитаем количество вещества хлороформа (молярная масса равна – 119 г/моль): n = V / Vm; n(CH4) = V(CH4) / Vm; n(CH4) = 4,48/ 22,4 = 0,2 моль. Согласно уравнению реакции n(CH4) : n(Cl2) = 1:3, т.е. n(Cl2) =3 × n(CH4) = 3 × 0,2 = 0,6 моль. Тогда объем хлора будет равен: V = n × Vm; V(Cl2) = n(Cl2) × Vm; V(Cl2) = 0,6 × 22,4 = 13,44 л. |
|
| Ответ | Объем хлора равен 13,44 л. |











