Формула этана
Определение и формула этана
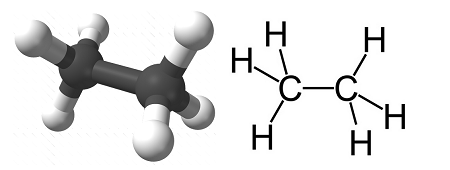
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – в обычных условиях бесцветный газ, не имеет вкуса и запаха. Взрыво- и пожароопасен.
Содержится в составе природного газа, нефти.
Этан впервые был получен на практике в 1834 году Майклом Фарадеем, который проводил электролиз раствора ацетата калия.
Он подумал, что образующееся вещество — это метан и не придал никакого значения своему открытию.
Химические свойства этана
- Для этана, как и для любого предельного углеводорода, типичными являются реакции, идущие по свободнорадикальному механизму, такие как галогенирование, нитрование и т.п.
Галогенирование:
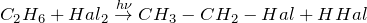
Нитрование:
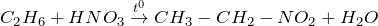
Сульфохлорирование:
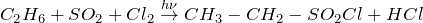
Окисление:
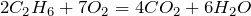
Термолиз:
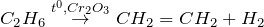
Применение
Этан является наилучшим сырьем для производства этилена, поскольку процесс идет с наибольшей селективностью, чем при применении других углеводородов.
Также этан используется в качестве хладагента в охлаждающих установках.
Примеры решения задач
| Задание | Газовую смесь |
| Решение | В исходной смеси присутствует этан — предельный углеводород, который с бромной водой реагировать не будет, поэтому в реакцию вступит только этилен:
Определим количество вещества брома, израсходованного в ходе химической реакции: Общее исходное количество брома равно: Так как Определим количество Отсюда объемные доли |
| Ответ |
| Задание | Смесь |
| Решение | Из данных газов лишь диметиламин реагирует с серной кислотой с образованием твердой соли, поэтому происходит уменьшение объема смеси.
Примем, что в При пропускании этой смеси через раствор серной кислоты протекает реакция: и в газовой фазе будет присутствовать только этан. Согдасно условию задачи объем газообразной смеси при этом уменьшился втрое, т.е. Так как газы в смеси находились при одних и тех же условиях, то по закону Авогадро: oтсюда: Массовые доли газов в смеси: |
| Ответ |











