Формула бериллата калия
Определение и формула бериллата калия

Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветные или белые кристаллы, в отсутствие влаги устойчивы на воздухе.
Средняя соль, образованная катионом калия и гидроксида бериллия.
Химические свойства бериллата калия
- Легко подвергается гидролизу:
![Rendered by QuickLaTeX.com \[ K_2BeO_1 + 2H_2O \rightarrow Be(OH)_2 + 2NaOH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-57b813a9549dfc3cda1da4217adce4d6_l3.png)
- При растворении бериллата калия в разбавленной щелочи образуется гидроксобериллат:
![Rendered by QuickLaTeX.com \[ K_2BeO_2 + 2H_2O \rightarrow K_2[Be(OH)_4] \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-debcf992363a40191e8e52e1f8cf1bef_l3.png)
-
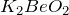 легко реагирует с минеральными кислотами различной силы и концентрации, с образованием
легко реагирует с минеральными кислотами различной силы и концентрации, с образованием 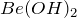 или соответствующей соли бериллия:
или соответствующей соли бериллия:
![Rendered by QuickLaTeX.com \[ K_2BeO_2 + 4HCl \rightarrow BeCl_2 + 2KCl + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5fb4412eff4bc155e7a960a8c18d2848_l3.png)
![Rendered by QuickLaTeX.com \[ K_2BeO_2 + H_2S \rightarrow Be(OH)_2 + K_2S \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a590ec6ddf6a5b2f22ef2059cd9237ae_l3.png)
Применение
На применении бериллата калия основан один из методов разделения бериллия и алюминия.
Примеры решения задач
| Задание | В колбу на |
| Решение | Рассчитаем молярную концентрацию соли бериллат калия Запишем реакцию гидролиза Из стехиометрии реакции следует, что Определим |
| Ответ |
| Задание | В колбу на 1 л поместили 1 г |
| Решение | Рассчитаем молярность раствора соли (молярную концентрацию) В щелочном водном растворе K_2BeO_2 превращается в комплексную соль: Запишем диссоциацию комплексной соли: Запишем выражение для константы нестойкости ( |
| Ответ | |











