Формула этена
Определение и формула этена
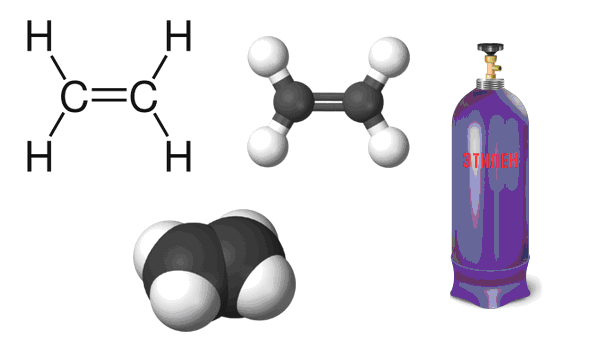
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – газообразное вещество, нерастворимое в воде.
Этилен в масштабных количествах выделяют из газов крекинга и коксования.
Химические свойства этилена
- Благодаря наличию двойной связи для этилена характерны реакции присоединения. Гидрирование протекает в присутствии катализаторов (Pd, Pt, Ni):
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + H_2 \rightarrow CH_3 - CH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-78a35e48582d53c0f313f7c44f9a4fc3_l3.png)
- Этилен легко присоединяет галогены и галогеноводороды. Например, при взаимодействии с бромной водой происходит ее обесцвечивание:
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + Br_2 \rightarrow CH_2Br - CH_2Br \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-648cf4f7ba6d34d45e7cc0933280b67f_l3.png)
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + HI \rightarrow CH_2I - CH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-355f4721bc99a724ec419f70140bc6d1_l3.png)
- Также можно с этиленом проводить реакцию гипогалогенирования:
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + HOCl \rightarrow CH_2OH - CH_2Cl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-08da208842bae57c5fcbfbed0ea79575_l3.png)
- При гидратации этена в присутствии катализатора
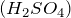 образуется этанол:
образуется этанол:
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + H_2O \rightarrow CH_3 - CH_2OH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0b80880f836e059a56de60725ccf921e_l3.png)
Применение
Этилен является важнейшим сырьем для производства полимеров, а именно таких как: полиэтилен, поливинилхлорид.
Из него в промышленных масштабах получают этанол, антифризы, уксусную кислоту.
Примеры решения задач
| Задание | Этанол |
| Решение | Напишем термохимическое уравнение реакции получения Чтобы вычислить теплоту химической реакции воспользуемся первым следствием из закона Гесса: Стандартные энтальпии образования веществ возьмем из справочника: Подставим найденные значения в формулу для вычисления теплоты: На основании вычисленного значения запишем полное термохимическое уравнение исходной реакции: |
| Ответ |
| Задание | Из |
| Решение | Под выходом продукта химической реакции подразумевают отношение объема полученного вещества в ходе эксперимента к объему, теоретически рассчитанного исходя из уравнения реакции:
Запишем уравнение реакции получения этилена путем дегидратации этанола: Определим количество вещества этанола из отношения его массы к молярной массе: Согласно данной задаче практический выход этилена равен Из Из Откуда: Исходя из найденного количества вещества этилена найдем его теоретический объем: |
| Ответ | |











