Формула муравьиной кислоты
Определение и формула муравьиной кислоты
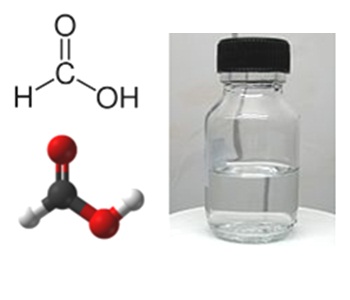
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветная жидкость, обладающая резким проникающим запахом при комнатной температуре.
Она смешивается с водой и многими полярными органическими растворителями, и в некоторой степени растворяется в углеводородах.
В углеводородах в паровой фазе, она состоит из связанных водородными связями димеров.
Благодаря тенденции к образованию водородных связей, газообразная муравьиная кислота не подчиняется закону идеального газа.
Твердая муравьиная кислота состоит из бесконечной сети связанных водородными связями молекул.
Химические свойства муравьиной кислоты
- Муравьиная кислота проявляет типичные кислотные свойства, например, она реагирует с щелочами:
![Rendered by QuickLaTeX.com \[ HCOOH + NaOH = HCOONa + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c66c38874e61297ef8d0497271f2eb27_l3.png)
- При нагревании с сильными водоотнимающими средствами, такими как концентрированная серная кислота, разлагается на
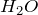 и
и 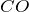 :
:
![Rendered by QuickLaTeX.com \[ HCOOH \rightarrow CO \uparrow + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c1c3c61922b134198fda8c0ee05ec0cf_l3.png)
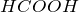 имеет некоторые свойства альдегидов. Она может окиляться до
имеет некоторые свойства альдегидов. Она может окиляться до 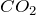 :
:
![Rendered by QuickLaTeX.com \[ 2KMnO_4 + 5HCOOH + 3H_2SO_4 \rightarrow K_2SO_4 + 2MnSO_4 + 5CO_2 \uparrow + 8H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d260a973e28d8e1ab36a727a8762b0e9_l3.png)
Применение
Муравьиная кислота широко используется в лабораторной практике, например, формилирование метиланилина в N-метилформанилин.
А также находит применение в медицине для обработки бородавок.
Примеры решения задач
| Задание | Рассчитайте равновесную концентрацию |
| Решение | Запишем выражение для константы равновесия:
Начальная концентрация муравьиной кислоты Запишем уравнение материального баланса: Выразим Выразим |
| Ответ |
| Задание | Определите изотонический коэффициент муравьиной кислоты с концентрацией ее в водном растворе |
| Решение | Получим выражение для степени диссоциации HCOOH через константу диссоциации:
Исходная концентрация Получим выражение для Запишем выражение связи изотонического коэффициента и степени диссоциации: |
| Ответ | |











