Формула ацетилена
Определение и формула ацетилена
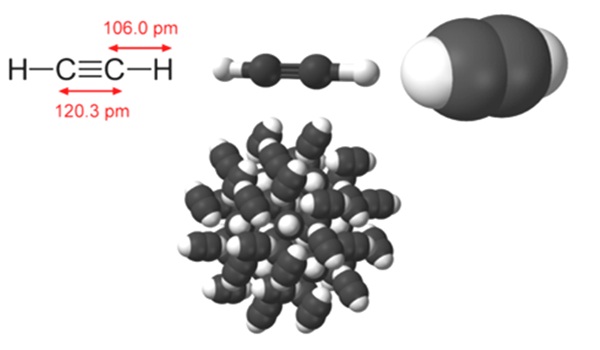
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветный газ, лишенный запаха в чистом состоянии, однако коммерческие образцы имеют выраженный запах благодаря наличию примесей.
Ацетилен находит применение в химической промышленности в качестве топлива и химического строительного блока.
Химические свойства ацетилена
- Наличие тройной связи обуславливает реакции присоединения. Например, гидрирование протекает в присутствии катализаторов
 :
:
![Rendered by QuickLaTeX.com \[ CH \equiv CH + 2H_2 \rightarrow CH_3 - CH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7841c3e1a4c5fc1ea3112bb13232f2ee_l3.png)
- Ацетилен последовательно вступает в реакции с галогенами и галогеноводородами:
![Rendered by QuickLaTeX.com \[ CH \equiv CH + 2Br_2 \rightarrow CHBr_2 - CHBr_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5705d52d5826a8ddf67ad2478ac0ab84_l3.png)
![Rendered by QuickLaTeX.com \[ CH \equiv CH + 2HBr \rightarrow CH_3 - CHBr_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-694f089f6ff44c9f9df2c6433cef7174_l3.png)
- Из-за наличия «кислого» водорода, ацетилен реагирует с щелочными металлами и вступает в реакцию «серебряного зеркала» с аммиачным раствором оксида серебра с образованием осадка ацетиленида серебра:
![Rendered by QuickLaTeX.com \[ CH \equiv CH + 2Na \rightarrow CHNa \equiv CHNa \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d77c85f11febf4ae15a4497b4db14396_l3.png)
Применение
Ацетилен применяют для газовой сварки и резки металлов, в производстве взрывчатых веществ.
Его широко используют и в органическом синтезе уксусной кислоты ![]() , различных органических растворителей.
, различных органических растворителей.
Примеры решения задач
| Задание | Рассчитайте на основании справочных данных среднюю энтальпию сольватации ацетилена в воде. |
| Решение | На основании первой задачи рассчитаем константу Генри Из первой задачи Рассчитаем среднюю энтальпию сольватации |
| Ответ | |
| Задание | На основании справочных данных рассчитайте растворимость ацетилена в воде в единицах молярности при различных температурах. |
| Решение | Из справочника химика 3 том, стр. 316 имеются данные зависимости коэффициента поглощения (коэффициента адсорбции Бунзена) от температуры при парциальном давлении газа При При Запишем уравнение связи коэффициента поглощения Запишем уравнение связи коэффициента растворимости Из уравнения состояния идеального газа следует Если Рассчитаем |
| Ответ |






![Rendered by QuickLaTeX.com \[ \ln \left ( \frac{K_2}{K_1} \right ) = \frac{\Delta H \cdot (T_2 - T_1)}{R \cdot T_2 \cdot T_1} \Rightarrow \Delta H = \frac{R \cdot T_1 \cdot T_2 \cdot \ln \left ( \frac{K_2}{K_1} \right ) }{T_2 - T_1} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ab49e534cee425751ae1889c4fe0cbf8_l3.png)





