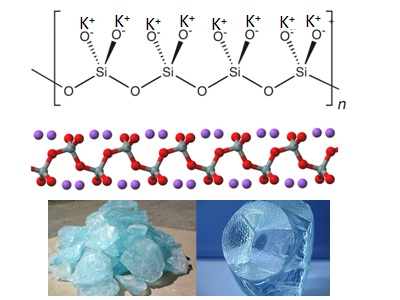
Формула силиката калия
Определение и формула силиката калия
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветное кристаллическое вещество, хорошо впитывающее влагу.
Средняя соль, образованная катионом калия и анионом слабой кремниевой кислоты.
Химические свойства силиката калия
- Силикат калия гидролизуется горячей водой:
![Rendered by QuickLaTeX.com \[ K_{2}SiO_{3}+ (n+1) H_{2}O \rightarrow 2KOH + SiO_{2} \cdot nH_2O \downarrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1d324aeef9b3a9e632d89d0f536f25ca_l3.png)
- Взаимодействует с кислотами:
![Rendered by QuickLaTeX.com \[ K_{2}SiO_{3} + 2HCl \rightarrow 2KCl + SiO_{2} \downarrow + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-787190200f610a98e3776678423e0cd9_l3.png)
- Вступает в химическую реакцию с
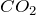 :
:
![Rendered by QuickLaTeX.com \[ K_{2}SiO_{3}+CO_{2} \rightarrow K_{2}CO_{3}+SiO_{2}\downarrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-73f522e52389b475755fa3329140fec4_l3.png)
Применение
Силикат калия используется в в качестве ингибитора коррозии, в косметической промышленности.
Может использоваться в виде кремнийсодержащего удобрения.
Примеры решения задач
| Задание | В |
| Решение | Рассчитаем молярность раствора (молярную концентрацию):
Определим приближенно изотонический коэффициент Рассчитаем осмотическое давление: |
| Ответ | |
| Задание | Рассчитайте pH раствора |
| Решение | Запишем диссоциацию данной соли и химическое уравнение ее гидролиза.
Молярная концентрация силикат-ионов равна концентрации соли: Гидролиз соли протекает по уравнению: Пусть x — прореагировавшая концентрация соли, тогда текущие концентрации: Найдем константу гидролиза Определим концентрацию Рассчитаем |
| Ответ |











