Формула нитрата меди (I)
Определение и формула нитрата меди
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
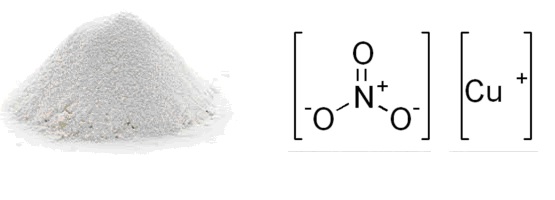
Физические свойства – это кристаллический белый порошок, при нагревании или интенсивном освещении разлагается.
Химические свойства нитрата меди (I)
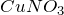 взаимодействует с щелочами и солями по обменному механизму с выпадением осадка или комплексообразованием, активно реагирует с окислителями.
взаимодействует с щелочами и солями по обменному механизму с выпадением осадка или комплексообразованием, активно реагирует с окислителями.
![Rendered by QuickLaTeX.com \[ CuNO_3 + NaOH = CuOH \downarrow + NaNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f2b9d2c3445aada40bab27569a9e34d9_l3.png)
![Rendered by QuickLaTeX.com \[ CuNO_3 + 2NaOH = Na[Cu(OH)_2] + NaNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3cb9018b6e2632c5236c8a83d7ff38bf_l3.png)
![Rendered by QuickLaTeX.com \[ CuNO_3 + HCl = CuCl \downarrow + HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-79f7ecee1733581cc0509cb21e6ca77e_l3.png)
![Rendered by QuickLaTeX.com \[ CuNO_3 + 2HCl = H[CuCl_2] + HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-873e0ce1548e8253f2662852740e83e2_l3.png)
![Rendered by QuickLaTeX.com \[ 4CuNO_3 + O_2 + 4HNO_3 = 4Cu(NO_3)_2 + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3e12e97c0c2b817dc612377969dc5f31_l3.png)
- При нагревании
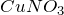 разлагается:
разлагается:
![Rendered by QuickLaTeX.com \[ 4CuNO_3 = 2Cu_2O + 4NO_2 \uparrow + O_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f080e16005cac031303882f744a7fd43_l3.png)
Получение
Нитрат меди (I) получают с помощью восстановления аммиачного раствора нитрата меди(II) металлической медью:
![]()
Применение
![]() используют для получения
используют для получения ![]() , который используется для крашения стёкл и эмалей и в полупроводниковой технике.
, который используется для крашения стёкл и эмалей и в полупроводниковой технике.
Примеры решения задач
| Задание | Сколько грамм |
| Решение | Вычислим число моль Запишем реакцию разложения Рассчитаем число моль и массу |
| Ответ |
| Задание | Сколько литров газа можно получить из |
| Решение | Запишем реакцию разложения:
Рассчитаем число моль Вычислим число моль Рассчитаем объем газа: |
| Ответ |











