Формула нитрата натрия
Определение и формула нитрата натрия
Плавится без разложения, но разлагается при дальнейшем нагревании. Хорошо растворяется в воде (не гидролизуется). Кристаллогидратов не образует. Практически не растворяется в концентрированной азотной кислоте. Сильный окислитель при спекании.

Рис. 1. Нитрат натрия. Внешний вид.
Химическая формула нитрата натрия
Химическая формула нитрата натрия NaNO3. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества (Ar(Na) =23а.е.м., Ar(N) = 14 а.е.м., Ar(O) = 16 а.е.м.):
Mr(NaNO3) = Ar(Na) + Ar(N) + 3×Ar(O);
Mr(NaNO3) = 23 + 14 + 3×16 = 23 + 14 + 48 = 85.
Структурная (графическая) формула нитрата натрия
Структурная (графическая) формула вещества является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы. Ниже представлена графическая формула нитрата натрия:
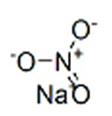
Ионная формула
Нитрат натрия электролит, поэтому он способен диссоциировать в водном растворе на ионы согласно следующему уравнению:
NaNO3 ↔ Na+ + NO3—.
Примеры решения задач
| Задание | При нейтрализации 25,5 г предельной одноосновной кислоты избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты. |
| Решение | Запишем уравнение реакции нейтрализации предельной одноосновной кислоты избытком раствора гидрокарбоната натрия в общем виде:
CnH2n+1COOH + NaHCO3 → CnH2n+1COONa + CO2↑ + H2O. Рассчитаем количество вещества выделившегося в ходе реакции углекислого газа: n = V / Vm; n(CO2) = V(CO2) / Vm; n(CO2) = 5,6 / 22,4 = 0,25 моль. Согласно уравнению реакции n(CO2): n(CnH2n+1COOH) = 1:1, т.е. n(CnH2n+1COOH) = n(CO2) = 0,25 моль. Рассчитаем молярную массу предельной одноосновной кислоты: M = m / n; M(CnH2n+1COOH) = m(CnH2n+1COOH) / n(CnH2n+1COOH); M(CnH2n+1COOH) = 25,5 / 0,25 = 102 г/моль. Определим число атомов углерода в молекуле предельной одноосновной кислоты (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода, 1 – для водорода и 16 для кислорода): M(CnH2n+1COOH) = 12n + 2n + 1 + 12 + 16 + 16 +1 = 14n + 46; 14n + 46 = 102 г/моль; 14n = 56; n = 4. Значит молекулярная формула предельной одноосновной кислоты C4H9COOH. |
| Ответ | C4H9COOH |
| Задание | Установите молекулярную формулу алкена, если известно, что 2,8 г его способны присоединить 1120 мл (н.у.) хлороводорода. |
| Решение | Запишем уравнение реакции присоединения хлороводорода к алкену в общем виде:
CnH2n + HCl → CnH2n+1Cl. Рассчитаем количество вещества хлороводорода: n = V / Vm; n(HCl) = V(HCl) / Vm; n(HCl) = 1,2 / 22,4 = 0,05 моль. Согласно уравнению реакции n(HCl): n(CnH2n) = 1:1, т.е. n(CnH2n) = n(HCl) = 0,05 моль. Рассчитаем молярную массу алкена: M = m / n; M(CnH2n) = m(CnH2n) / n(CnH2n); M(CnH2n) = 2,8 / 0,05 = 56 г/моль. Определим число атомов углерода в молекуле алкена (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода и 1 – для водорода): M(CnH2n) = 12n + 2n = 14n; 14n= 56 г/моль; n = 4. Значит молекулярная формула алкена C4H8. |
| Ответ | C4H8 |











