Формула пропановой кислоты
Определение и формула пропановой кислоты
В обычных условиях представляет собой бесцветную едкую жидкость с резким запахом. Самовоспламеняется при температуре 440oC. Смешивается с водой и органическими растворителями.
Химическая формула пропановой кислоты
Химическая формула пропановой кислоты может записываться двояко: C2H5COOH или C3H6O2. Она показывает, что в состав данной молекулы входят три атома углерода (Ar = 12 а.е.м.), шесть атомов водорода (Ar= 1 а.е.м.) и два атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу пропановой кислоты:
Mr(C3H6O2) = 3×Ar(C) + 6×Ar(H) + 2×Ar(O);
Mr(C3H6O2) = 3×12 + 6×1 + 2×16 = 36 + 6 + 32 = 74.
Структурная (графическая) формула пропановой кислоты
Структурная (графическая) формула пропановой кислоты является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 1).
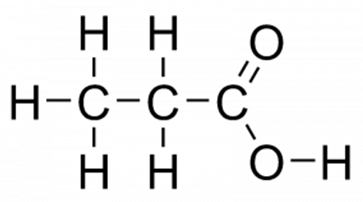
Рис. 1. Пропановая кислота. Графическая формула.
Примеры решения задач
| Задание | При нейтрализации 25,5 г предельной одноосновной кислоты избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты. |
| Решение | Запишем уравнение реакции нейтрализации предельной одноосновной кислоты избытком раствора гидрокарбоната натрия в общем виде:
CnH2n+1COOH + NaHCO3 → CnH2n+1COONa + CO2↑ + H2O. Рассчитаем количество вещества выделившегося в ходе реакции углекислого газа: n = V / Vm; n(CO2) = V(CO2) / Vm; n(CO2) = 5,6 / 22,4 = 0,25 моль. Согласно уравнению реакции n(CO2): n(CnH2n+1COOH) = 1:1, т.е. n(CnH2n+1COOH) = n(CO2) = 0,25 моль. Рассчитаем молярную массу предельной одноосновной кислоты: M = m / n; M(CnH2n+1COOH) = m(CnH2n+1COOH) / n(CnH2n+1COOH); M(CnH2n+1COOH) = 25,5 / 0,25 = 102 г/моль. Определим число атомов углерода в молекуле предельной одноосновной кислоты (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода, 1 – для водорода и 16 для кислорода): M(CnH2n+1COOH) = 12n + 2n + 1 + 12 + 16 + 16 +1 = 14n + 46; 14n + 46 = 102 г/моль; 14n = 56; n = 4. Значит молекулярная формула предельной одноосновной кислоты C4H9COOH. |
| Ответ | C4H9COOH |
| Задание | Установите молекулярную формулу алкена, если известно, что 2,8 г его способны присоединить 1120 мл (н.у.) хлороводорода. |
| Решение | Запишем уравнение реакции присоединения хлороводорода к алкену в общем виде:
CnH2n + HCl → CnH2n+1Cl. Рассчитаем количество вещества хлороводорода: n = V / Vm; n(HCl) = V(HCl) / Vm; n(HCl) = 1,2 / 22,4 = 0,05 моль. Согласно уравнению реакции n(HCl): n(CnH2n) = 1:1, т.е. n(CnH2n) = n(HCl) = 0,05 моль. Рассчитаем молярную массу алкена: M = m / n; M(CnH2n) = m(CnH2n) / n(CnH2n); M(CnH2n) = 2,8 / 0,05 = 56 г/моль. Определим число атомов углерода в молекуле алкена (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода и 1 – для водорода): M(CnH2n) = 12n + 2n = 14n; 14n= 56 г/моль; n = 4. Значит молекулярная формула алкена C4H8. |
| Ответ | C4H8 |











