Формула нитрата бериллия
Определение и формула нитрата бериллия

Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – твёрдое кристаллическое вещество белого цвета, существует в виде кристаллогидрата ![]() , хорошо растворимое в воде (107 г/100 мл при
, хорошо растворимое в воде (107 г/100 мл при ![]() ), температура плавления равна
), температура плавления равна ![]() , кристаллогидрат начинает разлагаться при
, кристаллогидрат начинает разлагаться при ![]() , безводная соль примерно при
, безводная соль примерно при ![]() , плотность кристаллической соли равна 1,56 г/см
, плотность кристаллической соли равна 1,56 г/см![]() .
.
Химические свойства нитрата бериллия
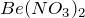 взаимодействует с щелочами и солями по обменному механизму с выпадением осадка или комплексообразованием:
взаимодействует с щелочами и солями по обменному механизму с выпадением осадка или комплексообразованием:
![Rendered by QuickLaTeX.com \[ Be(NO_3)_2 + 2NaOH = Be(OH)_2 \downarrow + 2HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e5b3dca1d148c53c17699bc90be186f5_l3.png)
![Rendered by QuickLaTeX.com \[ Be(NO_3)_2 + 4NaOH = Na_2[Be(OH)_4] + 2HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4cc2f61c097cb9bd51dec4f10564349e_l3.png)
![Rendered by QuickLaTeX.com \[ Be(NO_3)_2 + Na_2CO_3 = BeCO_3 \downarrow + 2NaNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d002eabc208be06452295e206ec39b0f_l3.png)
- При нагревании
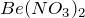 разлагается:
разлагается:
![Rendered by QuickLaTeX.com \[ 2Be(NO_3)_2 =2BeO + NO_2 \uparrow + O_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-75d0336ecdde442d7e3d5621c419849e_l3.png)
Получение
Нитрат бериллия получают с помощью следующих реакций:
![]()
![]()
![]()
Качественная реакция
Качественной реакцией на ионы бериллия является образование бесцветных шестиугольных и ромбических кристаллов, различимых под микроскопом при добавлении к раствору ацетилацетона (реакция проводится на предметном стекле):
![]()
Применение
![]() применяется как химического реагента и упрочнителя газокалильной сетки.
применяется как химического реагента и упрочнителя газокалильной сетки.
Примеры решения задач
| Задание | Как изменяется электродный потенциал полуреакции восстановления |
| Решение | Запишем диссоциацию соли и рассчитаем концентрацию ионов Запишем полуреакцию восстановления: Запишем выражение для электродного потенциала: |
| Ответ |
| Задание | Сколько грамм оксида металла можно получить из |
| Решение | Запишем реакцию термического разложения соли:
Рассчитаем число моль Из стехиометрических соотношений следует: Рассчитаем массу |
| Ответ |






![Rendered by QuickLaTeX.com \[ \frac{E_{NO_3^-/N_2}(pH = 0)}{E_{NO_3^-/N_2}(pH = 14)} =\frac{1,24}{0,2488} = 4,984 \approx 5 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b79e558c16aa656bd453f97498943f4f_l3.png)





