Формула нитрата меди 2
Определение и формула нитрата меди 2
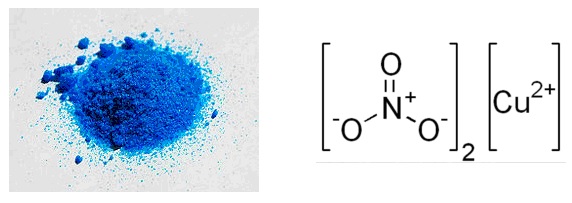
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – твёрдое кристаллическое вещество белого цвета, хорошо растворимое в воде (124,7 г/100 г H2O при ![]() ), образует кристаллогидраты голубого цвета, температура плавления безводного нитрата меди равна
), образует кристаллогидраты голубого цвета, температура плавления безводного нитрата меди равна ![]() , начинает разлагаться при
, начинает разлагаться при ![]() , плотность соли равна 3,05 г/см
, плотность соли равна 3,05 г/см![]() .
.
Химические свойства нитрата меди 2
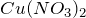 взаимодействует c металлами, стоящими в ряду напряжения левее меди, с щелочами, кислотами и солями по обменному механизму с выпадением осадка или комплексообразованием.
взаимодействует c металлами, стоящими в ряду напряжения левее меди, с щелочами, кислотами и солями по обменному механизму с выпадением осадка или комплексообразованием.
![Rendered by QuickLaTeX.com \[ Cu(NO_3)_2 + Fe = Fe(NO_3)_2 + 2Cu \downarrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e713f947f44b8faacb5462fcad8207fa_l3.png)
![Rendered by QuickLaTeX.com \[ Cu(NO_3)_2 + NaOH = Cu(OH)_2 \downarrow + NaNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ebf8eafc3ecf21ed7940ff22fd7d4c92_l3.png)
![Rendered by QuickLaTeX.com \[ Cu(NO_3)_2 + H_2S = CuS \downarrow + 2HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1e0f551959eee3f94971c05eed16959c_l3.png)
![Rendered by QuickLaTeX.com \[ 2Cu(NO_3)_2 + 4KCN = 2Cu(CN) \downarrow + (CN)_2 \uparrow + 4KNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ba21c1eee1279a55a8b12b2e9b2dc2e7_l3.png)
![Rendered by QuickLaTeX.com \[ 2Cu(NO_3)_2 + 10KCN = 2K_3[Cu(CN)_4] + (CN)_2 \uparrow + 4KNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-68d7daacc1fa68ba93543960aa3ad08e_l3.png)
- При нагревании
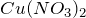 разлагается:
разлагается:
![Rendered by QuickLaTeX.com \[ 2Cu(NO_3)_2 = 2CuO + 4NO_2 \uparrow + O_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-983e56d70930f2e50946259786f51979_l3.png)
Получение
Нитрат меди (II) получают растворением в ![]() металлической меди,
металлической меди, ![]() или
или ![]() :
:
![]()
![]()
![]()
Применение
![]() используют для получения чистого
используют для получения чистого ![]() , для создания медьсодержащих катализаторов, в качестве фунгицида, а также как протраву при крашении тканей.
, для создания медьсодержащих катализаторов, в качестве фунгицида, а также как протраву при крашении тканей.
Качественная реакция
Качественной реакцией на ионы двухвалентной меди является образование красного осадка гексацианоферрата меди при добавлении к раствору ![]() :
:
![]()
Примеры решения задач
| Задание | Каково давление |
| Решение | Запишем реакцию:
Парциальные давления газов при равновесии: Запишем выражение для константы равновесия: Рассчитаем изменение энергии Гиббса реакции через энергию Гиббса образования: Рассчитаем Вычислим |
| Ответ |
| Задание | Рассчитайте средний коэффициент активности раствора |
| Решение | Запишем уравнение диссоциации соли:
Рассчитаем ионную силу раствора: Рассчитаем среднеионный коэффициент активности по первому приближению Дебая-Хюккеля, так как ионная сила мала: |
| Ответ |











