Формула фосфорной кислоты
Определение и формула фосфорной кислоты
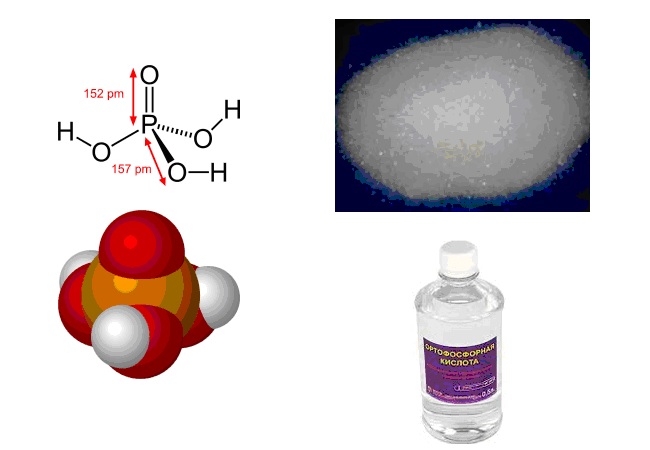
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – при комнатной температуре это бесцветные гигроскопичные кристаллы с температурой плавления ![]() , температурой кипения
, температурой кипения ![]() , растворимость в воде составляет 5,48 г/мл.
, растворимость в воде составляет 5,48 г/мл.
Химические свойства фосфорной кислоты
 — трёхосновная кислота средней силы. В водных растворах подвергается электролитической диссоциации в три стадии. Её показатели констант диссоциации имеют следующие значения
— трёхосновная кислота средней силы. В водных растворах подвергается электролитической диссоциации в три стадии. Её показатели констант диссоциации имеют следующие значения 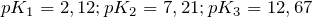 .
.
-
 взаимодействует c металлами, стоящими в ряду напряжения до водорода, с оксидами металлов, с основаниями, с солями и очень сильными кислотами:
взаимодействует c металлами, стоящими в ряду напряжения до водорода, с оксидами металлов, с основаниями, с солями и очень сильными кислотами:
![Rendered by QuickLaTeX.com \[ 3Mg + 2H_3PO_4 = Mg_3(PO_4)_2 \downarrow + 3H_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-765b126cb0e17a9f6ba9a4c44dd542b7_l3.png)
![Rendered by QuickLaTeX.com \[ Fe_2O_3 + 2H_3PO_4 = 2FePO_4 \downarrow + 3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-020c9dbe310f819d7ef20b6e2498efbb_l3.png)
![Rendered by QuickLaTeX.com \[ H_3PO_4 + 3NaOH = Na_3PO_4 + 3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0a741a4048fc666b31df0503807fff0a_l3.png)
![Rendered by QuickLaTeX.com \[ 2H_3PO_4 + 3CaCl_3 = Ca_3(PO_4)_2 \downarrow + 6HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-62dadc7bcfe051666bdff3209075c2ec_l3.png)
![Rendered by QuickLaTeX.com \[ H_3PO_4 + HClO_4 = [P(OH)_4]ClO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-611678ccc6d864c845171d9c77228a51_l3.png)
- При нагревании выше
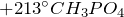 превращается в пирофосфорную кислоту
превращается в пирофосфорную кислоту 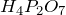 :
:
![Rendered by QuickLaTeX.com \[ 2H_3PO_4 = H_4P_2O_7 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3fc2b4a2c6c516cbc603479767cbc8b1_l3.png)
- При нагревании выше
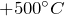 H_3PO_4 превращается в метафосфорную кислоту:
H_3PO_4 превращается в метафосфорную кислоту:
![Rendered by QuickLaTeX.com \[ H_3PO_4 = HPO_3 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6a179351e7c30f28120bd30e798bdeff_l3.png)
Получение фосфорной кислоты
- Фосфорную кислоту можно получить из фосфата кальция:
![Rendered by QuickLaTeX.com \[ Ca_3(PO_4)_2 + 3H_2SO_4 = 3CaSO_4 + 2H_3PO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d2ac0a5cfd83f3f61101c675001d349a_l3.png)
- Можно синтезировать гидролизом пентахлорида фосфора:
![Rendered by QuickLaTeX.com \[ PCl_5 + 4H_2O = H_3PO_4 + 5HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-98c703027457e3609039b1c795e6315a_l3.png)
- Также её получают взаимодействием с водой оксида фосфора
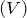 :
:
![Rendered by QuickLaTeX.com \[ P_2O_5 + 3H_2O = 2H_3PO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6c7a40679971c07f5f0b176c9ea31e0f_l3.png)
- Фосфорную кислоту в лабораторных условиях синтезируют окислением фосфора
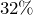 -ным раствором азотной кислоты:
-ным раствором азотной кислоты:
![Rendered by QuickLaTeX.com \[ 3P + 5HNO_3 + 2H_2O = 3H_3PO_4 + 5NO \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-92dd853c92580cbe6ccba661d19a12ed_l3.png)
Применение
Ортофосфорная кислота используется для очищения от ржавчины металлических поверхностей,
как пищевая добавка E338 (регулятор кислотности),
применяется в производстве удобрений,
в текстильной промышленности для крашения тканей,
в органическом синтезе в качестве катализатор,
в стоматологии для получения зубного цемента.
Качественная реакция
Качественной реакцией на фосфорную кислоту является образование ярко-жёлтого осадка молибденофосфата аммония:
![]()
и жёлтого осадка с нитратом серебра
![]()
Примеры решения задач
| Задание | Рассчитайте концентрацию (массовую долю) раствора |
| Решение | Вычислим массовую долю конечного раствора |
| Ответ |
| Задание | Возможно ли восстановить |
| Решение | Запишем уравнение химического взаимодействия:
Уравняем химическую реакцию: наименьшее общее кратное 10 Определим значение стандартной ЭДС |
| Ответ | Реакция протекает. |











