Формула силиката натрия
Определение и формула силиката натрия
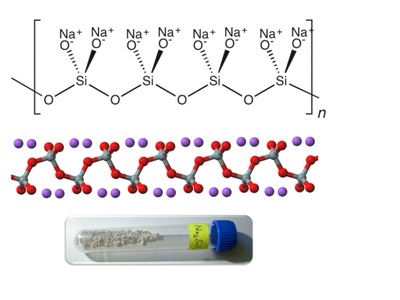
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – в чистом состоянии бесцветные или белые кристаллы, но обычно образцы имеют зеленоватый или синеватый оттенок благодаря наличию железосодержащих примесей.
Данное вещество — это соль, образованная катионом натрия и анионом метакремниевой кислоты.
В общем термин силикат натрия используется для соединений с формулой ![]() .
.
Также данное вещество известно как водное стекло или жидкое стекло, эти вещества известны как в водных растворах так и в твердой форме.
Метасиликат натрия растворяется в холодной воде, образует кристаллогидрат.
Химические свойства силиката натрия
- Силикат натрия химически медленно реагирует с водой, подвергаясь гидролизу:
![Rendered by QuickLaTeX.com \[ Na_{2}SiO_{3}+ (n+1) H_{2}O \rightarrow 2NaOH + SiO_{2} \cdot nH_2O \downarrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bd998602825723f2548df666e850a9d0_l3.png)
- Являясь солью взаимодействует с кислотами:
![Rendered by QuickLaTeX.com \[ Na_{2}SiO_{3} + 2HCl \rightarrow 2NaCl + SiO_{2} \downarrow + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8392e352e6a7b5a9bc2e0bb479931b69_l3.png)
- Разлагается щелочами:
![Rendered by QuickLaTeX.com \[ Na_{2}SiO_{3}+2NaOH \rightarrow Na_{4}SiO_{4}+H_{2}O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ddefad4f1625b864d533838d9b74ff7c_l3.png)
- Вступает в химическое взаимодействие с
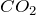 :
:
![Rendered by QuickLaTeX.com \[ Na_{2}SiO_{3}+CO_{2} \rightarrow Na_{2}CO_{3}+SiO_{2}\downarrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b316694fbcc5119c60694ee4769b6d05_l3.png)
Применение
Силикат натрия используется в приготовлении цементов, бетонов, текстильной промышленности.
Он — компонент шихты в производстве стекла.
Примеры решения задач
| Задание | Определите среднюю молярную массу раствора, содержащего |
| Решение | Рассчитаем число моль веществ в растворе Воспользуемся стандартной формулой: отношение массы вещества к его молярной массе: Рассчитаем мольную долю Определим среднюю молярную массу раствора.
Поставляя получим, |
| Ответ |
| Задание | Запишите формулу мицеллы, которая образуется при сливании двух растворов, содержащих 1 г |
| Решение | Запишем уравнение химической реакции:
Рассчитаем избыток-недостаток сливаемых растворов. Воспользуемся формулой из первой задачи для расчета количества вещества. Так как Серная кислота — сильный электролит и диссоциирует нацело. Запишем уравнение данного процесса. Запишем формулу полученной мицеллы. Здесь, |
| Ответ | |











