Формула этанола
Определение и формула этанола
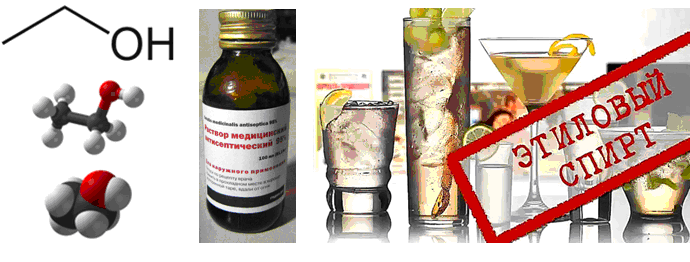
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветное жидкое вещество с характерным спиртовым запахом.
Хорошо смешивается с водой, образует с ней азеотропный состав.
Большое значение имеет получение абсолютного спирта путем фракционной перегонки.
Химические свойства этанола
- Химические свойства этанола связаны с наличием гидроксильной группы. Он реагирует с щелочными металлами с образованием этилатов:
![Rendered by QuickLaTeX.com \[ 2C_2H_5OH + 2Na \rightarrow 2C_2H_5ONa + H_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-882b79f498b21e3d3a407159f128c99d_l3.png)
- Другая известная реакция — это этерификация с образованием сложных эфиров:
![Rendered by QuickLaTeX.com \[ C_2H_5OH + CH_3COOH \rightarrow CH_3COOC_2H_5 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-131160a5ba391689d62a829e43e66901_l3.png)
- При действии на этанол водоотнимающих средств происходит отщепление воды. Процесс может идти как внутримолекулярно так и межмолекулярно. При этом образуется этилен или диэтиловый эфир соответственно:
![Rendered by QuickLaTeX.com \[ C_2H_5OH \rightarrow C_2H_4 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7811d8a8c5ca213f1f9ad1c0eb1ff59f_l3.png)
![Rendered by QuickLaTeX.com \[ C_2H_5OH + C_2H_5OH \rightarrow C_2H_5 - O - C_2H_5 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-84b08ffcb2171c0be1cb590abae0c0d3_l3.png)
- Может идти замещение гидроксильной группы при реакции с галогеноводородными кислотами, галогенидами фосфора:
![Rendered by QuickLaTeX.com \[ C_2H_5OH + HCl \leftrightarrow C_2H_5Cl + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e71368b5ff47deac47eb7450495ea5c3_l3.png)
- Этанол окисляется различными веществами (хромовая смесь,
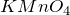 и т.д.). Процесс идет до этаналя, и далее может привести к образованию уксусной кислоты:
и т.д.). Процесс идет до этаналя, и далее может привести к образованию уксусной кислоты:
![Rendered by QuickLaTeX.com \[ C_2H_5OH \overset{[O]}{\rightarrow} CH_3COOH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d64873115956ad2dec75b4d50202dd69_l3.png)
Применение
Этанол широко используется в промышленном органическом синтезе дивинила, хлороформа, этилена высокой чистоты, этилового эфиру уксусной кислоты.
![]() находит применение и в качестве растворителя, особенно при производстве фармацевтических, душистых веществ.
находит применение и в качестве растворителя, особенно при производстве фармацевтических, душистых веществ.
Этанол является хорошим антисептиком.
Примеры решения задач
| Задание | Найдите температуру замерзания |
| Решение | Для решения задачи воспользуемся следствием из закона Рауля: температура замерзания раствора ниже температуры замерзания чистого растворителя:
Примем, что масса раствора равна Подставляя данные значения в формулу получим: Поскольку температура замерзания воды равна |
| Ответ | Температура замерзания раствора равна |
| Задание | Какой объем газообразного водорода при нормальных условиях выделится при взаимодействии |
| Решение | В данной задаче первоначально следует определить, какое вещество было взято в недостатке. Определим массу этилового спирта вступившего в реакцию:
Запишем реакцию взаимодействия этанола с натрием: Исходя из данного уравнения на два моля этилового спирта приходится два моля натрия и один моль водорода. Определим количество вещества этанола: Поскольку заданное количество вещества натрия составляло
|
| Ответ | |











