Формула хлорной кислоты
Определение и формула хлорной кислоты
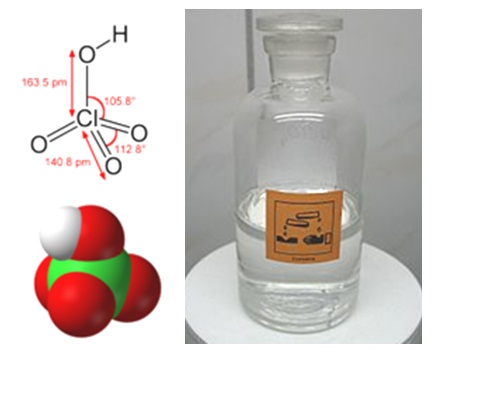
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветная гигроскопичная легкоподвижная жидкость, концентрированные растворы маслообразны.
Данная кислота сильнее серной и азотной.
Она образует бесцветный жидкий водный раствор.
Она является сильным окислителем в нагретом состоянии, но ее водные растворы вплоть до ![]() весовых процентов при комнатной температуре не демонстрируют окислительных свойств.
весовых процентов при комнатной температуре не демонстрируют окислительных свойств.
Хлорная кислота необходима для получения перхлоратов, особенно перхлората аммония – важного компонента ракетного топлива.
Химические свойства хлорной кислоты
- Хлорная кислота проявляет свойства сильных минеральных кислот вступая в химическое взаимодействие с гидроксидами щелочных металлов (реакция нейтрализации):
![Rendered by QuickLaTeX.com \[ HClO_4 + NaOH = NaClO_4 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-569c92f2bef7c347a6418c534ee7777e_l3.png)
- Реагирует с хлоридами щелочных металлов:
![Rendered by QuickLaTeX.com \[ HClO_4 + CsCl = CsClO_4 + HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-76a556bdc3671e433e36861bdbb148f0_l3.png)
- Безводная кислота взаимодействует с графитом:
![Rendered by QuickLaTeX.com \[ 4HClO_4 + 7C = 7CO_2 \uparrow + 2Cl_2 \uparrow + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a36d45197f31ec3a89ea36aaae0ce2c2_l3.png)
Применение
Ежегодно производится несколько миллионов килограмм.
Она применяется для извлечения руд и обладает уникальными свойствами в аналитической химии.
Примеры решения задач
| Задание | В |
| Решение | Рассчитаем понижение температуры замерзания:
Рассчитаем моляльность раствора: Определим изотонический коэффициент Вычислим кажущуюся степень диссоциации |
| Ответ | |
| Задание | Рассчитайте |
| Решение | Запишем уравнение диссоциации хлорной кислоты:
Определим ионную силу растворов: z — заряд иона Рассчитаем коэффициент активности Рассчитаем активность Вычислим коэффициент активности Вычислим активность Рассчитаем коэффициент активности Рассчитаем активность |
| Ответ |






![Rendered by QuickLaTeX.com \[ \lg \gamma (H^+) = -0,51 \cdot z^2 (H^+) \cdot \left [\frac{\sqrt{I}}{1 + \sqrt{I}} - 0,2 \cdot I \right ] = \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-fb9b1fcd1d558b226f744637e8d00068_l3.png)





