Формула этилена
Определение и формула этилена
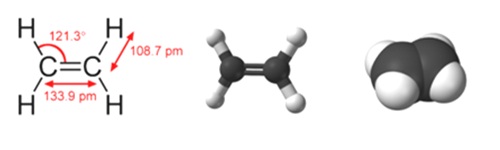
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветное газообразное горючее вещество, в чистом состоянии обладает слабым сладким и мускусным запахом.
Этилен находит исключительно важное и широкое применение в химической промышленности, и его мировая добыча занимает ведущее положение.
Химические свойства этилена
- Наличие двойной связи подразумевает вступление этилена в реакции присоединения. Например, гидрирование происходит в присутствии катализаторов
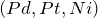 :
:
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + H_2 \rightarrow CH_3 - CH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-78a35e48582d53c0f313f7c44f9a4fc3_l3.png)
- Этилен легко вступает в реакции с галогенами и галогеноводородами. Например, при взаимодействии с бромной водой происходит ее обесцвечивание. Данная реакция является качественной на непредельные соединения:
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + Br_2 \rightarrow CH_2Br - CH_2Br \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-648cf4f7ba6d34d45e7cc0933280b67f_l3.png)
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + HI \rightarrow CH_2I - CH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-355f4721bc99a724ec419f70140bc6d1_l3.png)
- Также, интересной реакцией является гипогалогенирование:
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + HOCl \rightarrow CH_2OH - CH_2Cl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-08da208842bae57c5fcbfbed0ea79575_l3.png)
- При гидратации этилена в присутствии катализатора, например
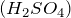 , образуется этиловый спирт:
, образуется этиловый спирт:
![Rendered by QuickLaTeX.com \[ CH_2=CH_2 + H_2O \rightarrow CH_3 - CH_2OH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0b80880f836e059a56de60725ccf921e_l3.png)
Применение
Значительная часть этилена идет на производство полиэтилена, повсеместно используемого пластика, содержащего полимерные цепи полиэтилена с различной длиной цепи.
Этилен является важным природным гормоном растений, влияющим на процесс созревания плодов.
Важным продуктом гидратации этилена является этанол.
Примеры решения задач
| Задание | Определите константу равновесия процесса гидрирования этилена при |
| Решение | Запишем уравнение гидрирования этилена до этана. Данный процесс обратим, поэтому для него можно найти константу равновесия.
В задаче требуется найти константу равновесия процесса при стандартной температуре, хотя известно, что процесс гидрирования обычно протекает в значительно более жестких условиях: при нагревании и присутствии катализатора. На основании закона Гесса рассчитаем изменение энергии Гиббса реакции: Подставляя в данную формулу наши значения, получим: Вычислим константу равновесия: |
| Ответ |
| Задание | Определите константу скорости гидрирования |
| Решение | Рассчитаем константу скорости по уравнению Аррениуса по справочным данным:
|
| Ответ | |











