Формула аммиака
Определение и формула аммиака
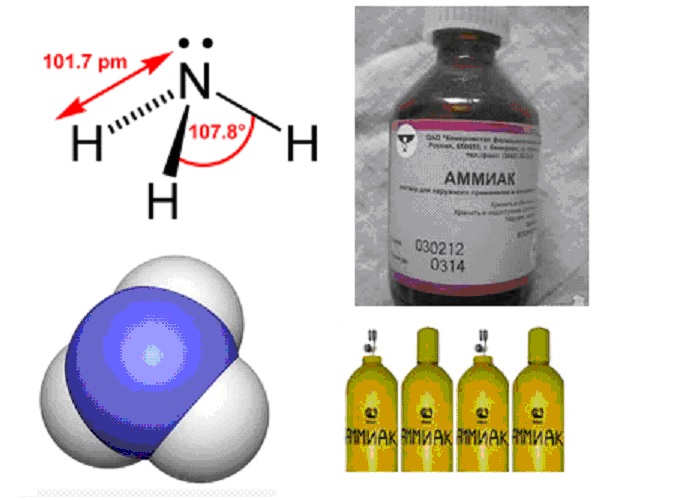
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – аммиак представляет из себя бесцветный газ с резким запахом, температура плавления ![]() , температура кипения
, температура кипения ![]() , он хорошо растворяется в воде (при
, он хорошо растворяется в воде (при ![]() 30 массовых
30 массовых ![]() с плотностью 0,892 г/мл), спирте и ряде других органических растворителей.
с плотностью 0,892 г/мл), спирте и ряде других органических растворителей.
Химические свойства аммиака
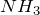 проявляет амфотерные свойства (кислотные свойства очень слабые) поэтому взаимодействует с щелочными металлами, с кислотами, с окислителями, с ионами переходных металлов:
проявляет амфотерные свойства (кислотные свойства очень слабые) поэтому взаимодействует с щелочными металлами, с кислотами, с окислителями, с ионами переходных металлов:
![Rendered by QuickLaTeX.com \[ 2NH_3 + 2Na = 2NaNH_2 + H_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-76f3e294621f51f2c20b859ac5970472_l3.png)
![Rendered by QuickLaTeX.com \[ NH_3 + HCl = NH_4Cl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c49161e02f271df364b47eeb4dd6c2d6_l3.png)
![Rendered by QuickLaTeX.com \[ 2NH_3 + 3CuO = 3Cu + N_2 + 3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b20ae4fbb2a7b26249faff976ff8e24b_l3.png)
![Rendered by QuickLaTeX.com \[ NH_3 + CuSO_4 = [Cu(NH_3)_4]SO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-70effe5ee11547ffa34c2229625366c7_l3.png)
Получение аммиака
В промышленности аммиак получают прямым взаимодействием водорода и азота в присутствии различных катализаторов (платина, никель, железо):
![]()
В лаборатории аммиак получают действием сильных щелочей на соли аммония при нагревании:
![]()
Применение
Аммиак применяется для получения азотных удобрений, взрывчатых веществ, различных полимеров, используется в производстве азотной кислоты, соды и других продуктов химической промышленности, также нашёл применение в медицине в качестве возбудителя дыхания, стимулятора рвоты, примочек. Жидкий аммиак применяется как растворитель.
Качественная реакция
Качественной реакцией на аммиак является посинение смоченной водой лакмусовой бумаги. Другая качественная реакция на аммиак – это образование жёлто-бурого осадка при взаимодействие аммиака с реактивом Несслера:
![]()
Примеры решения задач
| Задание | Рассчитайте константу равновесия реакции растворения осадка |
| Решение | Запишем уравнения протекающих реакций:
Запишем константу реакции через табличные величины и рассчитаем ее: |
| Ответ | |
| Задание | 1 литр газа при нормальных условиях, содержащий |
| Решение | Запишем уравнения протекающих реакций:
Рассчитаем исходное число моль Вычислим избыточное число моль Найдем число моль Рассчитаем число моль и объем Рассчитаем объемную долю |
| Ответ |











