Формула азотной кислота
Определение и формула азотной кислоты
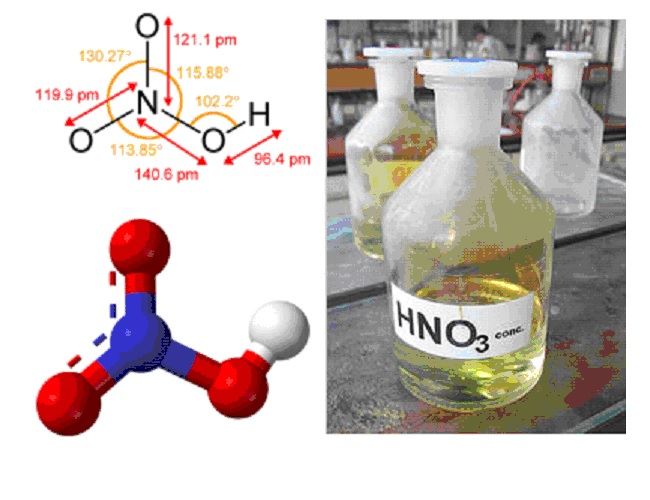
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – при стандартных условиях представляет из себя бесцветную жидкость с плотностью 1,5129 г/мл, которая дымит на воздухе, её температура плавления составляет ![]() , кипения
, кипения ![]() .
.
Азотная кислота смешивается с водой без ограничений.
Химические свойства азотной кислоты
- При взаимодействии
 с металлами никогда не образуется водород, а могут образовываться различные оксиды азота, молекулярный азот или катион аммония. Чем активнее металл и разбавленнее кислота, тем глубже она восстанавливается.
с металлами никогда не образуется водород, а могут образовываться различные оксиды азота, молекулярный азот или катион аммония. Чем активнее металл и разбавленнее кислота, тем глубже она восстанавливается.
![Rendered by QuickLaTeX.com \[ Cu + 4HNO_3_{(conc.)} = Cu(NO_3)_2 + 2NO_2 \uparrow + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f3b9e166a55026be3a44e10dd0185d61_l3.png)
![Rendered by QuickLaTeX.com \[ Cu + 8HNO_3_{(dilute)} = 3Cu(NO_3)_2 + 2NO \uparrow + 4H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7c817d8a0170c093a0493942c0cf57a7_l3.png)
- При взаимодействии с неметаллами наблюдается та же тенденция:
![Rendered by QuickLaTeX.com \[ S + 6HNO_3_{(conc.)} = H_2SO_4 + 6NO_2 \uparrow + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-13656cb9d4e85a7071b6b30882539241_l3.png)
![Rendered by QuickLaTeX.com \[ S + 2HNO_3_{(dilute)} = H_2SO_4 + 2NO \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a9cbc8fc82deb02eddd0870fc1001597_l3.png)
- Кислота вступает в различные реакции обмена:
![Rendered by QuickLaTeX.com \[ HNO_3 + NaOH = NaNO_3 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2921c7758d132438e213625219cf03b7_l3.png)
![Rendered by QuickLaTeX.com \[ 2HNO_3 + ZnO = Zn(NO_3)_2 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-499240dcb7083b6ad1affc42172eeb32_l3.png)
![Rendered by QuickLaTeX.com \[ Na_2CO_3 + 2HNO_3 = 2NaNO_3 + CO_2 \uparrow + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c6078f86615b075543ba631e557b18fb_l3.png)
- Очень концентрированная
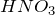 имеет бурый цвет раствора вследствие протекания на свету реакции разложения:
имеет бурый цвет раствора вследствие протекания на свету реакции разложения:
![Rendered by QuickLaTeX.com \[ 4HNO_3 = 4NO_2 \uparrow + O_2 \uparrow + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-360da67e7c826d2dcdee5c8ef307ffa6_l3.png)
Применение
Азотная кислота используется для получения взрывчатки, как окислитель ракетного топлива, применяется в производстве удобрений, красителе, лекарств, в органическом синтезе, в ювелирном деле.
Примеры решения задач
| Задание | При стоянии |
| Решение | Запишем реакцию:
Рассчитаем изменение энергии Гиббса реакции через энергию Гиббса образования: Вычислим константу равновесия по уравнению нормального сродства: |
| Ответ |
| Задание | Вычислите теплоту, которая выделится при нейтрализации |
| Решение | Рассмотрим реакцию нейтрализации:
Рассчитываем тепловой эффект: |
| Ответ | |











