Формула хлорида кальция
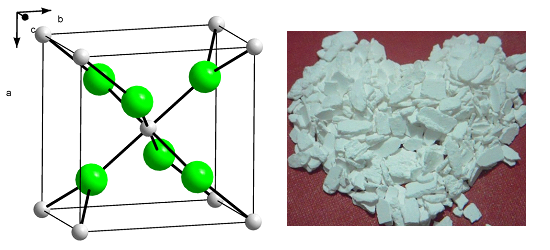
Определение и формула хлорида кальция
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белые кристаллы, плавящиеся без разложения.
Расплывается на воздухе из-за энергичного поглощения влаги.
Хорошо растворяется в воде (не гидролизуется).
Образует кристаллогидрат состава ![]() .
.
Химические свойства хлорида кальция
- Хлорид кальция вступает в реакции обмена с кислотами:
![Rendered by QuickLaTeX.com \[ CaCl_2+H_2SO_4=CaSO_4 \downarrow +2HCl \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b0c383c4117e2ae05affc47d47e95955_l3.png)
- Взаимодействует с щелочами:
![Rendered by QuickLaTeX.com \[ CaCl_2 + 2NaOH = Ca(OH)_2 + 2NaCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0bfbd2dde0da9860e20138d30c229fa9_l3.png)
- При высокой температуре в присутствии катализатора реагирует с водородом:
![Rendered by QuickLaTeX.com \[ CaCl_2 + H_2 = CaH_2 + 2HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-35645159cf27d621bf63c13eb38431e8_l3.png)
Получение
Хлорид кальция можно получить по реакции обмена:
![]()
При взаимодействии оксида кальция и хлора при высокой температуре:
![]()
Применение
Хлорид кальция находит разнообразное применение, особенно в неорганическом синтезе, в качестве консерванта (при консервировании овощей и фруктов), противогололёдное средство; как отвердитель в продуктах питания.
Примеры решения задач
| Задание | Рассчитайте сколько грамм кальциевой соли может получиться из 1 л одномолярного раствора |
| Решение | Запишем уравнение химической реакции:
Рассчитаем количество моль Из уравнения реакции следует, что Вычислим массу сульфата кальция |
| Ответ |
| Задание | Рассчитайте массовую и мольную доли хлорида кальция в его кристаллогидрате |
| Решение | Из формулы кристаллогидрата следует, что в 1 моль Вычислим массу Определим массовую долю |
| Ответ |











