Формула сульфата аммония
Определение и формула сульфата аммония
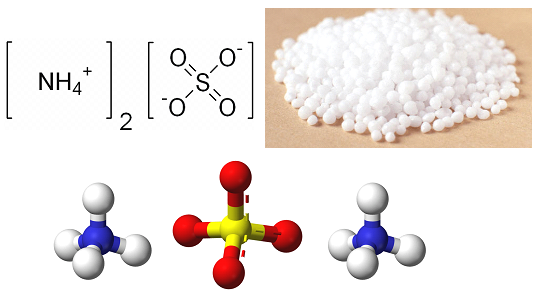
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белое кристаллическое вещество.
При нагревании разлагается, хорошо растворяется в воде.
Не образует кристаллогидратов.
Гидролизуется по катиону.
Химические свойства сульфата аммония
- При нагревании разлагается выше
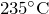 разлагается на гидросульфат аммония и аммиак:
разлагается на гидросульфат аммония и аммиак:
![Rendered by QuickLaTeX.com \[ (NH_4)_2SO_4 = NH_4HSO_4 + NH_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-27aaa1369a862088b9d19409828dc912_l3.png)
- Реагирует с концентрированным раствором гидроксида натрия:
![Rendered by QuickLaTeX.com \[ (NH_4)_2SO_4 + 2NaOH = Na_2SO_4 + 2NH_3 \uparrow + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b770c7eef4d3057f64961b6da59354be_l3.png)
- Вступает в реакции обмена с солями:
![Rendered by QuickLaTeX.com \[ (NH_4)_2SO_4 + BaCl_2 = BaSO_4 \downarrow + 2NH_4Cl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-05da163cad2f7e3177753a156aa0664e_l3.png)
- Реагирует с сильными окислителями:
![Rendered by QuickLaTeX.com \[ (NH_4)_2SO_4 + 2KMnO_4 = 2MnO_2 \downarrow + N_2 \uparrow + 4H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bc44580674116608a5ccaec04011f650_l3.png)
Получение
Сульфат аммония можно получить по реакции раствора аммиака с серной кислотой:
![]()
Применение
Основной областью применения сульфата аммония является использование его в качестве удобрения.
В пищевой промышленности применяется в качестве пищевой добавки ![]() .
.
На его основе изготовляются самодельные взрывчатые вещества.
Примеры решения задач
| Задание | Какую массу аммиака нужно взять, чтобы получить 1 кг сульфата аммония? |
| Решение | Запишем уравнение химической реакции образования сульфата аммония из аммиака:
Определим количество моль сульфата аммония: Из стехиометрии реакции следует, что: Определим массу аммиака, тогда: |
| Ответ | |
| Задание | Определите массовую долю сульфата аммония в растворе, который имеет осмотическое давление 1 атм при |
| Решение | Сульфат аммония — сильный электролит и диссоциирует нацело с образованием трех частиц:
Запишем выражение для определения осмотического давления для сильного электролита: где Пересчитаем молярную концентрацию в массовую долю, приняв плотность раствора за единицу, так как концентрация мала: Подставим численные значения: |
| Ответ | Массовая доля сульфата аммония в растворе равна |











